常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
(3)向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值_______(填“增大”、“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5)取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g) △H1= +131kJ/mol
C(s)+O2(g)=CO2(g) △H2= —394kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3= —283kJ/mol
则CO(g)+H2O(g)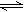 H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g)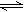 H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
反应达平衡时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
5 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验l中以 CO2表示的反应速率为 。
②在900℃时,此反应的平衡常数K=
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,达到新平衡时CO的转化率将 (变大、变小、不变)
(3)将标准状况下224mLCO2通入200mL 0.1 mol/L KOH溶液中,充分反应后得到溶液X,若不考虑溶液体积的变化,下列有关X的叙述不正确的是
A、c(OH-)=c(H+)+ c(HCO3—)+ 2c(H2CO3)
B、该溶液中,c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+)
C、该溶液中,水电离出的c(OH-)大于水电离出的c(H+)
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则该电池负极的反应式为 。
若将该电池作电源,以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,理论上至少需要消耗标况下的CO气体 mL
某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
(2)如图1是0.1mol•L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol•L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol•L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol•L﹣1(填数值)
(3)室温时,向100mL 0.1mol•L﹣1 NH4HSO4溶液中滴加0.1mol•L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
经测定某溶液中只含Na+、CH3COO—、H+、OH—四种离子,已知该溶液中含有一种或两种溶质。查资料表明等物质的量浓度的醋酸和醋酸钠等体积混合后溶液呈酸性,试完成下列各题。
(1)试推测能组成这种溶液的可能的溶质或组合是 ;(用化学式表示)
(2)有关这种溶液,下列说法不正确的是( )
A.若溶液中离子间满足c(CH3COO—)>c(Na+)>c(H+)>c(OH—),则溶液中溶质一定为CH3COOH和CH3COONa
B.若溶液中离子间满足c(Na+)>c(CH3COO—)>c(OH—)>c(H+),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)= c(CH3COO—),则该溶液一定呈中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定呈酸性
(3)若溶液是由体积相等的醋酸溶液和氢氧化钠溶液混合而成,而且恰好呈中性,则混合前
c(CH3COOH) c(NaOH)(填“大于”、“小于”或“等于”),混合前两溶液中分别的
c(H+) c(OH—)(同上);
(4)若溶液为等体积、等物质的量浓度的醋酸和醋酸钠溶液混合而成,则混合后溶液中的离子浓度关系正确的是 。
A.c(CH3COO—) + c(OH—) = c(Na+)+ c(H+)
B.c(CH3COO—)+ 2c(OH—)= c(CH3COOH)+2 c(H+)
C.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
D.2c(Na+)= c(CH3COOH)+ c(CH3COO—)
(10分)化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g)△H>0 (I)
TaI4(g)+S2(g)△H>0 (I)
反应(I)的平衡常数表达式K= 。若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为 。
(4)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下NaHSO3的水解平衡常数
Kh= mol/L。若向NaHSO3溶液中加入少量的I2,则溶液中c(H2SO3)/(HSO3-)将 (填“增大”“减小”或“不变”)。
以下是25 ℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填名称)而除去。
(2)①中加入的试剂应选择 为宜。
(3)②中除去Fe3+所发生的总反应的化学方程式为 。
(4)下列关于方案③相关的叙述中不正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
C.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+能大量存在
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:
①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液
pH由小到大的顺序为_________________ _(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数
Kh= mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”),请写出离子浓度大小关系式: 。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+ c(CH3COOH)= ,m与n的大小关系是m n(填“>”“=”或“<”)。
由短周期元素组成的A、B两种盐可发生下列变化,且B的焰色反应呈黄色(图中其它生成物未列出)
(1)A和B的混合物溶于水发生反应的离子方程式_______________________.
(2)B、E两溶液混合反应时,可观察到的现象是________________________,写出其反应的离子方程式________________.
(3)室温下,向0.01mol·L-1NH4HSO4溶液中滴加0.01mol·L-1 NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______ 。
(4)25℃,将a mol·L-1的氨水与0.0lmol·L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-)。则溶液显____ 性(填“酸’’、“碱”或“中”);用含a的代数式表示NH3·H2O在25℃时的电离平衡常数Kb= 。
(16分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
(16分)物质在水溶液中可能存在电离平衡、盐的水解平衡
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
_________________
。
(3)NH3·H2O 的电离方程式是 ,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-) (填“增大”“减小”“不变”)。
(4)已知某温度下K(NH3·H2O)=1.69×10-5,则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(5)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________(填“<”、“>”或“=”)n。
(10分)最近雾霾天气肆虐我国大部分地区,其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是 。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7,H2CO3的电离常数为K1=4.30×10-7,K2=15.60×10-11,则下列微粒可以大量共存的是 (填序号)
A.CO32- 、HSO3- B.HSO3-、HCO3- C.SO32- 、HCO3- D.HCO3-、H2SO3
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
①根据上表判断NaHSO3溶液显 性,试解释原因
②在NaHSO3溶液中离子浓度关系不正确的是
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(H2SO3)+c(H+)= c(SO32-)+c(OH-)
C.c(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-)
D.c(H+)+ c(Na+)=2c(SO32-)+c(HSO3-)+ c(OH-)
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
(10分)已知H2SO3是二元弱酸,常温下现有0.1 mol/L H2SO3溶液,请回答以下问题:
(1)若向H2SO3溶液中加入少量NaHSO3固体,此时溶液中c(H+)/ c(HSO3-)________(填“增大”“减小”或“不变”)。
(2)若向H2SO3溶液中加入等浓度的NaOH溶液,且二者的体积比为2∶3,若反应后溶液可使紫色石蕊变红色,则所得溶液中物料守恒式为0.1 mol/L=______________,所得溶液中各离子的物质的量浓度由大到小的顺序是__________________。
(3)若向H2SO3溶液中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______2c(SO32-)(选填“>”、“<”或“=”)。
(4)若向H2SO3溶液中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中
2c(SO32-) +c(HSO3-)-c(Na+)=________mol/L。