四川省成都高新区高三11月统一检测化学试卷
下图为雾霾的主要成分示意图。下列说法不正确的是
| A.苯是最简单的芳香烃 |
| B.利用丁达尔效应可检验雾霾是否为胶体 |
| C.NxOy都属于酸性氧化物 |
| D.推广燃煤脱硫技术可以减少SO2形成酸雨 |
下列说法正确的是
①乙烯的结构简式:CH2CH2
②HF的电子式:
③HClO的结构式:H—O—Cl
④基态碳原子的价电子排布图:
⑤基态Cr的价电子排布式:3d44s2
⑥斜长石KAlSi3O8的氧化物形式可表示为:K2O•Al2O3•6SiO2
| A.①③ | B.③④ | C.④⑤ | D.③⑥ |
下列有关晶体的说法中一定正确的是
①原子晶体中只存在非极性共价键
②稀有气体形成的晶体属于原子晶体
③干冰晶体升华时,分子内共价键会发生断裂
④金属元素和非金属元素形成的化合物一定是离子化合物
⑤离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键
| A.①③ | B.只有⑤ | C.②④⑤ | D.③⑤ |
已知33As、35Br位于同一周期。下列关系正确的是
| A.原子半径:As>Cl>P | B.热稳定性:HCl>AsH3>HBr |
| C.还原性:As3->S2->Cl- | D.酸性:H3AsO4>H2SO4>H3PO4 |
对下图两种化合物的结构或性质描述正确的是
| A.不是同分异构体 |
| B.分子中共平面的碳原子数相同 |
| C.均能与溴水反应 |
| D.可用红外光谱区分,但不能用核磁共振氢谱区分 |
下列叙述正确的是
| A.NH4Cl和CaC2都是离子化合物 |
| B.由碳氮原子形成的某种化合物比金刚石还坚硬,其主要原因是碳氮键比碳碳键更长 |
| C.因为液态氟化氢中存在氢健,所以其分子比氯化氢更稳定 |
| D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10 |
下列对一些实验事实的理论解释正确的是
| |
实验事实 |
理论解释 |
| A |
SO2溶于水形成的溶液能导电 |
SO2是电解质 |
| B |
白磷为正四面体分子 |
白磷分子中P—P间的键角是109°28′ |
| C |
1体积水可以溶解700体积氨气 |
氨是极性分子;可与水形成氢键;且与水反应 |
| D |
HF的沸点高于HCl |
H—F的键长比H—Cl的键长短 |
NA代表阿伏加德罗常数,下列叙述正确的是
| A.0.1 mol丙烯酸中含有双键的数目为0.1NA |
| B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA |
C.一定条件下定容容器中充入3molH2(g)和1 mol N2(g)发生反应:H2(g)+ N2(g) 2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA 2NH3(g);△H= -QkJ/mol,当该反应放出0.25QkJ的热量时,容器中的氢分子数共有2.25 NA |
| D.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在pH=1的溶液中:K+、Na+、SO42–、 IO3-、I- |
| B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42– |
| C.0.1 mol/L的NaNO3溶液:H+、Fe2+、Cl-、SO42- |
| D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是
| A.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| B.W、Y、Z的电负性大小顺序可能是Z>W>Y |
| C.Y、Z形成的分子一定为极性分子 |
| D.WY2分子中σ键与π键的数目之比是1:1,且与SiO2分子互为等电子体 |
下列离子方程式表达正确的是
A.向漂白粉溶液中通入少量CO2的离子方程式: 2ClO-+CO2+H2O===2HClO+ |
B.用铜为电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| C.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S:5OH-+3H2S=HS-+2S2-+5H2O |
| D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O |
已知下列实验事实
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验③证明氧化性:Cr2O72->I2 |
| D.实验②证明H2O2既有氧化性又有还原性 |
已知A、B为单质,C为化合物, ,能实现上述转化关系的是
,能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
下列有关实验操作、现象和解释或结论都正确的是
| A.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ |
| B.某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水,有白色沉淀出现,说明该钾盐是K2CO3 |
| C.Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D.用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色,浓氨水呈碱性 |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,
则下列说法正确的是
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g)  H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 molO2 反应放出115.6 kJ热量,键能如表所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
下列说法不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电极A极反应式为:2NH3-6e-=N2+6H+ |
| D.当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol |
下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g)ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
4NO2(g)+O2(g)ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/(mol·L-1) |
5.00 |
3.52 |
2.50 |
2.50 |
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数K1=125
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再次平衡时c(N2O5)>5.00 mol·L-1
(1)请用下列物质的序号填空:①NaF ②C2H4 ③Na2O2 ④Ba(OH)2 ⑤ CO2;只含有极性键的是 ,既有离子键又有非极性键的是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序是 。某氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
①写出基态Cu2+的核外电子排布式: ;在周期表中的位置是 。
②如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为 。
③CuO高温易转化为Cu2O,其原因是 。
X~R是元素周期表中的短周期元素,其相关信息如下表:
| 元素 |
X |
Y |
Z |
W |
R |
| 相关信息 |
能形成+7价的化合物 |
日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 |
通常状况下能形成短周期中最稳定的双原子分子 |
焰色反应为黄色 |
最外层有二个未成对电子,无正价 |
请用化学用语回答下列问题:
(1)基态原子X的核外电子所处最高能层的能层符号是 。
(2)Z的氢化物的电子式 ,中心原子的杂化类型是 ,元素Z、R的气体氢化物的稳定性顺序是 ,Z的氢化物易液化,原因是 。
(3)R的某种氢化物C有18个电子,工业上利用电解KHSO4水溶液所得的产物与水反应制备C。电解KHSO4水溶液时(该条件下 部分电离),阳极反应式是
部分电离),阳极反应式是 ,阴极反应式是 ;已知1mol
,阴极反应式是 ;已知1mol 与水反应得到C时转移了2 mol e-,则该反应的离子方程式是 。
与水反应得到C时转移了2 mol e-,则该反应的离子方程式是 。
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍: ,则该反应的△ H 0(选填“>”或“<”)。
,则该反应的△ H 0(选填“>”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △ H 1=-393.5kJ·mol-1
CO2(g)+C(s) =2CO(g) △ H 2=+172.5kJ·mol-1
S(s)+O2(g) =SO2(g) △ H 3=-296.0kJ·mol-1
请写出CO除SO2的热化学方程式 。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO 和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 。
(4)下图是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。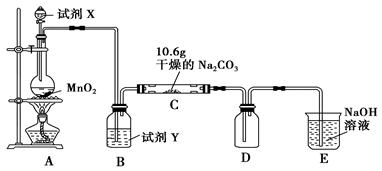
(1)写出装置A中发生反应的化学方程式: 。
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄棕色的气体,其为含氯氧化物。可以确定的是C中含氯化合物(盐)只有一种,且含有NaHCO3,现对C的成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于a、b试管中。 |
|
| 步骤2: |
情况①: 情况②: |
| 步骤3: |
|
(4)D中黄棕色的气体化学式为 。
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号