下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O H3O++CO32- H3O++CO32- |
B.PO43-+3H2O H3PO4+3OH- H3PO4+3OH- |
C.NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
D.H2O+H2O H3O++OH- H3O++OH- |
室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
| A.Ⅱ表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗V(NaOH)小于20 mL |
| C.V(NaOH)="20.00" mL时,两份溶液中c(Cl-)=c(CH3COO-) |
| D.V(NaOH)="10.00" mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
向体积Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是
| A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
下列判断中,正确的是
| A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3 |
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是
| A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) |
| C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
H2SO3是二元弱酸,NaHSO3溶液呈酸性。在0.1 mol/L NaHSO3溶液中,下列关系正确的是
| A.c(HSO3-) > c(SO32-) > c(H2SO3) |
| B.c(Na+) = c(HSO3-) + 2c(SO32-) + c(HSO3) |
| C.c(Na+) = c(HSO3-) > c(H+) > c(OH-) |
| D.c(Na+) + c(H+) = c(HSO3-) + c(OH-) + c(SO32-) |
下列事实中,不能用勒沙特列原理来解释的是
| A.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体 |
B.对于反应H2(g)+I2(g)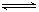 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
常温下,浓度均为0.1mol·L-1的三种溶液:①CH3COOH 溶液 ②NaOH 溶液 ③CH3COONa溶液。下列说法不正确的是
| A.溶液的pH :②>③>① |
| B.水电离出的c(OH- ):③>①>② |
| C.①和③等体积混合后的溶液:c(H+)+c(CH3COOH) =c(OH- )+c(CH3COO-) |
| D.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol·L-1 |
在pH为4~5的环境中,Cu2+ 、Fe2+ 不能生成沉淀,而Fe3+几乎完全沉淀。工业上制取CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解,欲除去溶液中的杂质离了,下列方法正确的是
| A.加入纯Cu将Fe2+ 还原 |
| B.向溶液中加入(NH4)2S 使Fe2+沉淀 |
| C.直接加水加热使杂质离子水解除去 |
| D.在溶液中通入Cl2,再加入CuO粉末调节pH为4-5 |
下列说法不正确的是
| A.0.1mol/L硫酸铵溶液中各离子的浓度由大到小的顺序是:c (NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.在苏打与小苏打的混合溶液中存在:c(Na+)+c(H+) ="c(OH" -)+2c(CO32-)+c(HCO3-) |
| C.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,证明Na2CO3溶液中存在水解平衡 |
| D.常温常压下能自发进行的反应,一定都是放热反应 |
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl;②适量的NaCl;③适量的氨水;④适量的NaOH,正确的是
| A.①② | B.③ | C.③④ | D.④ |
同时对农作物施用含N、P、K的三种化肥,对给定的下列化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4,⑤氨水,最适当的组合是
| A.①③④ | B.①③⑤ | C.②③④ | D.②③⑤ |
向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是
| A.整个反应过程中:c(H+) + c(Na+) + c(NH4+)=c(OH-) + 2c(SO42-) |
| B.当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+) |
| C.当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+) |
| D.当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-) |
下列说法正确的是:
A.在100 ℃、101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH =" 40.69" kJ•mol-1 H2O(l) 的ΔH =" 40.69" kJ•mol-1 |
| B.100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
C.已知: 则反应  的焓变为: 的焓变为:ΔH=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1 = -384 kJ•mol-1 |
| D.常温下,在0.10 mol•L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |