(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g) pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如右图所示,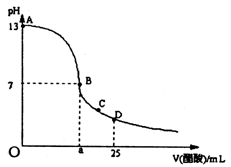
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 。
(2)该氢氧化钠溶液的物质的量浓度为 mol·L—1。
(3)在B点,a 12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH)____ c(CH3COOH),混合前酸中 c(H+)和碱中c(OH-)的关系:c(H+)________ c(OH-)。
(4)在D点溶液中离子浓度大小关系为 。
(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-。请回答下列有关问题:
H++SO42-。请回答下列有关问题:
(1)K2SO4溶液呈_______(填“弱酸性”、“中性”或“弱碱性”),其理由是 (用离子方程式表示)。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为 。
(3)若25℃时,0.10 mol/L的NaHSO4溶液中c(SO42-)="0.03" mol/L,则HSO4-的电离常数Ka= (保留两位有效数字)。0.10 mol/L的H2SO4溶液中c(H+) 0.13mol/L (填“>”、“=”或“<”)。
C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为______(用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为_________________。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:_________________。
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_________________。
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢
2H2O 2H2↑+O2↑
2H2↑+O2↑
D天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
从3 min到9 min,v(H2)=_______mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
下表是不同温度下水的离子积数据:
| 温度(℃) |
25 |
t1 |
t2 |
| 水离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α (填“>”、“>”或“=”)1×10-14,作出此判断的理由是 。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为 。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)= mol·L-1。
(3)t2℃下:①0.01 mol·L-1的氢氧化钠溶液的pH= 。
②若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是 。
现代传感信息技术在化学实验中有广泛的应用。

Ⅰ.某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中制取NH3的化学方程式为 ,检验三颈瓶集满NH3的方法是 。
(2)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
Ⅱ.测定NH3•H2O的浓度及电离平衡常数Kb
(3)从三颈瓶中用 (填仪器名称)量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据、电脑绘制滴定曲线如下图。

(4)据图,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= ,当pH=11.0时计算Kb的近似值,Kb≈ 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.未滴加酸碱指示剂,实验结果不科学 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
(1)25℃时水的电离平衡曲线应为 (选填“A”或“B”)
(2)25℃时,将PH=9的NaOH溶液与PH=4的盐酸溶液混合,若所得混合溶液的PH=7,则NaOH溶液与盐酸溶液的体积比为 。
(3)95℃时,若100体积PH=a的某强酸溶液与1体积ph=b的某强碱溶液混合后溶液呈中 性,则混合前,a与b之间应满足的关系是
有三溶液:A.BA(OH)2,B.NAOH,C.NH3·H2O(以下用编号ABC表示,)
(1)pH值相等时,三种溶液浓度由大到小的顺序为__________ _______
(2)物质的量浓度相等时,pH值由大到小的顺序为_____________ ____
(3)pH=11时,各100mL与同浓度的HCl中和,消耗HCl体积由多到少的顺序为____________
(4)浓度相等时,各100mL与同浓度HCl中和,消耗HCl体积由多到少的顺序为_____________
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________;
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________;
(3)a的取值范围是_______________________________________。
(共4分)
(1)25℃时,水的离子积常数KW为1.0×10—14;在pH=2的稀硫酸中,c(OH—) = ;若升高温度,会使KW 数值 (填“增大”、“减小”或“不变”)。
(2)在醋酸水溶液中存在平衡CH3COOH CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是 ,能使溶液pH增大的是 (填序号)。
水的电离平衡曲线如下图所示。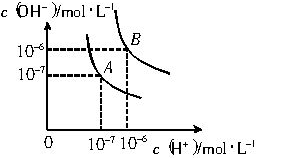
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH)2溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH)2的离子积为 。
(4))25℃时,在等体积的 ① pH=0的H2SO4溶液、②0.05mol/L的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是 。
(5)等体积的下列溶液中,阴离子的总物质的量最大的是_________(填序号)。
① 0.1 mol·L-1的CuSO4溶液
② 0.1 mol·L-1的Na2CO3
③ 0.1 mol·L-1的KCl
④ 0.1 mol·L-1的NaHCO3
(6)某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+ + HA-,HA- H+ + A2- 。
H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
物质的类别和核心元素的化合价是研究物质性质的两个重要视角。硫及其化合物与价态变化为坐标的二维转化关系如图所示。完成下列填空:
(1)图中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式: ;
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度
分析,理论上有可能实现的方案是 (选填编号)。
a.Na2S + S b.Z + S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2·12H2O +____S = ____K2SO4 + ____Al2O3 + ____SO2↑ +
(4)研究反应Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓ + SO2↑+ H2O的速率时,下列方案合理的是 (选填编号)。
a.测定一段时间内生成SO2的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(s)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S 和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到1mol硫,放出270kJ的热量。写出该治理烟道气反应的热化学方程式 。
(6)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是 。
在工农业生产和科学研究中,许多重要的化学反应需要在水溶液中进行,试分析并回答以下问题:
(1)向体积均为20.00 mL、浓度均为0.1 mol·L-1盐酸和醋酸溶液中分别滴加0.1 mol·L-1 NaOH溶液。随加入的NaOH溶液体积的增加,溶液pH的变化如下图所示:
①用NaOH溶液滴定醋酸溶液的曲线是__________________(填“I”或“Ⅱ”);
②实验前,上述三种溶液中由水电离出的c(H+)最大的是______________溶液(填化学式);
③图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”);
④图I中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是:
______>______>______>________(用离子的物质的量浓度符号填空)。
(2)为了研究沉淀溶解平衡,某同学查阅资料并设计了如下实验(相关数据测定温度及实验环境均为25℃):
资料:AgSCN是白色沉淀;Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17
①步骤2中溶液变红色,说明溶液中存在SCN-,该离子经过步骤1中的反应,在溶液中仍然存在,原因是:_____________(用必要的文字和方程式说明);
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为________(至少答出两条明显现象);
③写出步骤4中沉淀转化反应平衡常数的表达式:K=______________。
(14分)砷(As)广泛分布于自然界,其原子结构示意图是 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。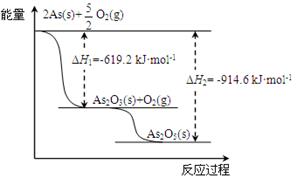
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+ AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应是 。
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针______(填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。
As2O5与NaOH溶液反应的离子方程式是 。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。