t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)该温度下,水的离子积常数Kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= ,此时该溶液中由水电离的c(OH-)= 。
(3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(1)从能量角度看,断开化学键要 ,形成化学键要 ,一个化学反应是释放能量还是吸收能量取决于 ;水的分解需要吸收热量,试从化学键变化的角度分析原因 。
(2)4克硫粉完全燃烧时放出37kJ热量,该反应的热化学方程式是: 。
(3)现在下列物质:①100℃的纯水;②25℃0.1mol/LHCl溶液;③25℃0.1mol/LKOH溶液;④25℃0.1mol/LBa(OH)2溶液。
这些物质与25℃纯水相比,能促进水的电离的是 (填序号,以下同);
能抑制水的电离的是 ;
水电离的c(OH-)水等于溶液中c(OH-)的是 ;
水电离的c(H+)水等于溶液中c(H+)的是 ;
以上可得出一个结论,纯水中加入酸、碱,可 水的电离(填促进、抑制、不影响)
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
(1)配平氧化还原反应方程式:
________C2O42-+________MnO4-+________H+===________CO2↑+________Mn2++________H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作______________(填“氧化剂”或“还原剂”),该滴定过程______________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果______________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果____________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为____________,KHC2O4的质量分数为______________。
(每空2分,共6分)
某温度下水的离子积为KW =1×10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b= ;
(2)若所得混合液的pH=2,则a∶b= ;
(3)若所得混合液的pH=10,则a∶b= 。
某温度(T ℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积Kw为______________,则该温度T_____________25(填“>”、“< 或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
| 实验序号 |
Ba(OH)2溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则a=_____________________,实验②中由水电离产生的c(OH-)=________________mol·L-1。
(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
| |
甲 |
乙 |
丙 |
丁 |
| 0.1 mol·L-1 Ba(OH)2溶液体积/mL |
10 |
10 |
10 |
10 |
| 0.1 mol·L-1 NaHSO4溶液体积/mL |
5 |
10 |
15 |
20 |
①按丁方式混合后,所得溶液显________________(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式:_________________________。
③按甲方式混合后,所得溶液的pH为______________________。
已知醋酸是日常生活中常见的弱酸。
(1)用pH试纸测定醋酸pH的操作是__________________。
(2)常温下在pH=5的醋酸稀溶液中,醋酸电离出的c(H+)的精确值是__ mol·L-1。
(3)用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液,部分操作如下:
①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数
②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙
③滴定时,边滴加边振荡,同时注视滴定管内液面的变化
请选出上述实验过程中的错误之处__________________(填序号)。上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器是__________________。
25 ℃时,电离平衡常数:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
|
| 电离平衡常数 |
1.8×10-5 |
K1 4.3×10-7 K2 5.6×10-11 |
3.0×10-8 |
|
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是_____________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(2)下列反应不能发生的是: ;
a.CO32- + CH3COOH=CH3COO- + CO2 ↑ + H2O
b.ClO- + CH3COOH=CH3COO- + HClO
c.CO32- + HClO=CO2 ↑+ H2O + ClO-
d.2 ClO- + CO2 + H2O=CO32-+ 2 HclO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是_________;
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
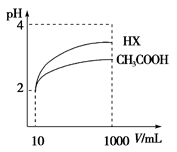
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
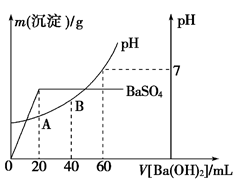
①原混合溶液中c(H+)=___________________;c(Cl-)=_________________。
②A点的pH=_________________。
③将0.15 mol·L-1稀硫酸V1mL与0.1 mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
(溶液体积变化忽略不计)。
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO‾+H+ ΔH>0。
CH3COO‾+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO‾)=_________;下列方法中,可以使0.10 mol·L‾1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L‾1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L‾1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L‾1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb。
(4)已知:90℃时,水的离子积常数为Kw = 38×10‾14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__________(保留三位有效数字)。
实验室利用饱和NaNO2溶液(12mol/L)和NH4Cl溶液加热制备N2。
(1)若配制250 mL上述NaNO2溶液需要的玻璃仪器 ,可用 法收集N2。
(2)写出上述实验原理的离子方程式 并标出电子转移的数目和方向(单线桥法或双线桥法都可)
(3)NH4Cl溶液中加人镁粉也可以产生气体,写出相应的化学方程式
(4)向20 mL 0.01 mol/L的HNO2溶液中逐滴滴加相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液的体积的变化如图所示:(已知HNO2的电离平衡常数为K=4.6X10-4)则图中a点的c(H+)= ,b点溶液呈酸性的原因是(结合离子方程式表示) (已知 )。
)。

现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是________。
A. c(H+) B. c(H+)/ c(CH3COOH)
C. c(H+)·c(OH-) D. c(OH-)/ c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)_____pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
HClO |
| 电离平衡常数K1 |
1.8×10-5 |
4.3×10-7 |
3.0×10-8 |
| K2 |
—— |
5.6×10-11 |
—— |
下列四种离子结合H+能力最强的是______________。
A. HCO3- B. CO32- C. ClO- D. CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):_________________;
HClO+Na2CO3(少量):___________________。
按要求填空。
(1)某温度下,纯水中c (H+)=4.0×10-7 mol·L1,则此时c (OH-)= mol·L-1。若温度不变,滴入稀硫酸使c (H+)=8.0×10-6 mol·L1,则c (OH-) = mol·L-1。
(2)某温度时,水的离子积常数KW=10-12,则该温度_______(选填“大于”“小于”或“等于”)25℃。若将此温度下pH=10的NaOH溶液aL与pH=1的稀硫酸bL混合,(设混合后溶液体积的微小变化忽略不计),若所得混合液为中性,则a:b=_______;若所得混合液pH=2,则a:b=_______。
化合物KaFeb(C2O4)c·dH2O(其中铁为正三价)是重要的光化学试剂。通过下述实验确定该晶体的组成。
步骤a:称取该样品4.91g溶于水中配成250mL溶液,取出25mL溶液,向其中加入过量的NaOH溶液,将沉淀过滤,洗涤,高温灼烧至质量不再改变,称量其固体的质量为0.08g。
步骤b:另取出25mL溶液,加入适量稀H2SO4溶液,用0.050 mol·L-1KMnO4溶液滴定,到达滴定终点时,消耗KMnO4溶液24.00mL。
已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2+8H2O
(1)草酸(H2C2O4)为二元弱酸,其一级电离的方程式为 。草酸的Ka1约为Ka2的1000倍,可能的原因是 。
(2)滴定终点观察到的现象为 。
(3)通过计算确定样品的组成(写出计算过程)。
(1).250C时,①0.1mol·L-1的盐酸②0.2mol·L-1的硫酸 ③0.1mol·L-1的醋酸④0.1mol·L-1的氨水⑤0.1mol·L-1的NaOH溶液⑥0.1mol·L-1的Ba(OH)2溶液,其pH由小到大的顺序是_____(填序号)
(2)下列物质中①NaCl ②BaSO4 ③H2SO4 ④KOH ⑤石墨⑥H2CO3 ⑦CH3COOH ⑧NH3·H2O ⑨蔗糖⑩酒精⑪SO2 ⑫Cu ⑬Cl2 ⑭CO2。其中属于强电解质的有_________;其中属于弱电解质的有__________;其中属于非电解质的有________。
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,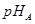 ____
____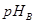 (填“>”“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积VA_______VB.(填“>”“=”或“<”)。
(填“>”“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积VA_______VB.(填“>”“=”或“<”)。
(4)250C时,若10体积某强碱溶液与1体积的某强酸溶液混合后,溶液的pH=7,则混合前,该强碱溶液的pH与强酸溶液pH之间应满足的关系是__________。