PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为_________________。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: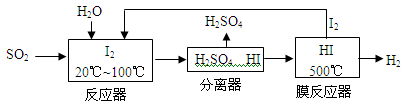
①用离子方程式表示反应器中发生的反应:_________________。
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_________________。
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢
2H2O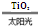 2H2↑+O2↑
2H2↑+O2↑
D天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。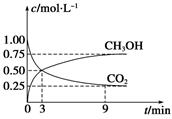
从3 min到9 min,v(H2)=_______mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
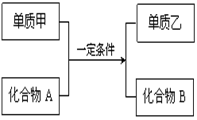
 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是 ,写出铝粉与所用试剂反应的离子方程式 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号