已知水在25℃和95℃时,其电离平衡曲线如下图所示:
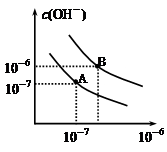
(1)则95℃时水的电离平衡曲线应为 (填“A”或“B”)。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,所得溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)95℃时,若1体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是(用含a、b的等式表示):
(14分)用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1)用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl的pH 7(填“<”、“=”或“>”),显 性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为 ;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为 。
(3)若对NH4Cl溶液进行测定,溶液中浓度最大的是 离子,微粒个数最少的是 离子。
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol。
②_ __和_ 两种粒子的物质的量之和比OH―多0.05mol。
在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡的体积/mL |
硫酸氢钠的体积/mL |
溶液的pH |
| ① |
33.00 |
0.00 |
8 |
| ② |
33.00 |
x |
7 |
| ③ |
33.00 |
33.00 |
6 |
(1)依据题意判断,t℃___________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积常数Kw = ___________。
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )>c(
)>c( )
)
B.c( )+c(
)+c( )=c(
)=c( )+2c(
)+2c( )+c(
)+c( )
)
C.c( )+c(
)+c( )=c(
)=c( )+c(
)+c( )
)
D.两溶液中c( )、c(
)、c( )、c(
)、c( )分别相等
)分别相等
(14分)甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加人盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体。
(1) 甲、乙、丙的化学式分别为____________
(2) 250C时,PH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为______。
(3) 写出⑤中发生反应的离子方程式____________
(4) 250C时,将a mol/L CH3COOH溶液与0.02 mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)="______" (忽略混合时溶液体积的变化)。
(5) 等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该
元素的质量相等,则乙溶液和丙溶液的体枳比可能为______ (填选项字母)。
| A.3:1 | B.1:3 | C.7:1 | D.1:7 |
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”、“小于”、“等于”或“无法确定”),若二者恰好反应所得溶液的pH<7,原因是__________________。(用离子方程式表示)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=________。
在常温下,下列五种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
④0.1mol/L 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L; 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" ) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图 ,工业上制取R单质的化学方程式为
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式 ;D的电子式
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为
②如果A,B均为由以上某些元素组成的盐,则A溶液显 性,原因是(用离子方程式表示) 。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为 。
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=____________.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7(>、≥ 、=、<)。
②若溶液pH>7,则c(Na+)________c(A-),理由是________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
已知:25℃时,H2SO3 Ka1=1.5×10﹣2 Ka2=1.0×10﹣7
H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10﹣11
HNO2 Ka=5.1×10﹣4 HClO Ka=3.0×10﹣8
饱和NaClO溶液的浓度约为3mol/L.
(1)室温下,0.1mol/L NaClO溶液的pH 0.1mol/L Na2SO3溶液的pH(选填“大于”、“小于”或“等于”).浓度均为0.1mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣浓度从大到小的顺序为 。
(2)下列离子反应正确的有: .
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是: .
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的pH约为12,主要是因为:ClO﹣+H2O HClO+OH﹣
HClO+OH﹣
C.该消毒液加白醋生成HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol下列气体分别与1L0.l mol·L﹣1的NaOH溶液反应(已知2NO2+2NaOH═NaNO2+NaNO3+H2O),形成的溶液的pH由大到小的顺序为: (用A、B、C、D表示).
A.NO2 B.SO3 C.SO2 D.CO2.
(5)下列说法不正确的是( )
A.在相同温度下将pH相同的稀硫酸和醋酸溶液等体积混合,所得混合液的pH与原来相同。
B.含等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH溶液加水稀释后,溶液中c(H+)/C(CH3COO-)的值减小
(6)已知某温度下,0.10mol/LNH4Cl溶液的PH=5,则该温度下NH3·H2O的电离常数约为 。
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
19.下表是不同温度下水的离子积数据:
| 温度 / ℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是____________。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=________
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=____________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
(8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列(填序号)。 |