在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中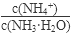 将 (填“增大”、“减小”或“不变”);
将 (填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因
,此时溶液中各离子浓度由大到小的顺序为 ;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1 V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式 。
常温下,取0.2 mol/L HA溶液与0.2 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(2)已知NH4A溶液显中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(3)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl |
按pH由大到小的顺序排列__________________(填字母序号)。
(1)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液
(假设无损失),
①__ 和_ 两种粒子的物质的量之和等于0.1mol。
②_ 和_ 两种粒子的物质的量之和比OH―多0.05mol。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中
各离子浓度大小顺序可能有如下四种关系:
| A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) | B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) | D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小
顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后
溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)
常温下,取0.2 mol/L HA溶液与0.2 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(2)已知NH4A溶液显中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(3)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl。按pH由大到小的顺序排列__________________(填字母序号)。 |
(8分)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4—, HSO4  H++SO42—。
H++SO42—。
请回答下列有关问题:
(1)Na2SO4溶液呈 填“弱酸性”、“中性”或“弱酸性”);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为 ;
(3)在0.10mol·L—1的Na2SO4溶液中,下列离子浓度关系正确的是 (填写编号)
| A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4) |
| B.c(OH—)=c(HSO4—)+c(H+) |
| C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)="2" c(SO42—)+2 c(HSO4—) |
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式 ;
常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3②NaHCO3③HCl ④NH3?H2O(1)上述溶液中,可发生水解的是 (填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的
顺序为 。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值 (填增大、
减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填
大于、小于、等于)。
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)= 。
(Ⅰ)
现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)现有下列电解质溶液:①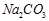 ②
②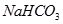 ③
③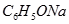 ④
④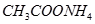 ⑤
⑤ (已知酸性
(已知酸性 。)
。)
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号) 。
(2)常温下,物质的量浓度相同的①、②、③溶液pH大小顺序为(填序号) > > 。
(3)写出⑤与足量NaOH溶液混合加热时反应的离子方程式 。
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。
在a.b两支试管中,分别装上质量相等形状相同的一颗锌粒,然后向两支试管中:
(1)分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。则
a.b两支试管中的现象:相同点是 ;不同点是
反应完毕后生成气体的总体积是a b。
(2)分别加入相同PH、相同体积的稀盐酸和稀醋酸时,两支试管中的反应速率在反应刚开始时是a b(填“大于”、“等于”或“小于”下同),当两种酸都反应完毕后生成气体的体积是a b
写出下列几种溶液的pH或pH的范围
(1)0.05mol/LH2SO4溶液 ;(2)0.01mol/LNaOH溶液
(3)pH=12NaOH溶液加水稀释100倍 ;
(4))pH=5HCl溶液加水稀释1000倍 。
(12分)在温度T ℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
7 |
| ③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=________。
(2)b=________,原Ba(OH)2稀溶液的物质的量浓度为________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为________,其中Na2SO4的物质的量浓度为________。
某同学用0.1082mol/L 的NaOH溶液滴定未知浓度的盐酸,以下是实验数据记录表。
| 实验序号 |
待测盐酸溶液的体积mL |
滴定管读数 |
消耗标准NaOH溶液的体积mL |
|
| 初读数 |
末读数 |
|||
| 1 |
20.00 |
0.00 |
19.90 |
19.90 |
| 2 |
20.00 |
0.05 |
|
|
列出求算待测盐酸溶液浓度的计算式(须含上表相关数据,不必计算结果)
某同学用0.1082mol/L 的NaOH溶液滴定未知浓度的盐酸,以下是实验数据记录表。
| 实验序号 |
待测盐酸溶液的体积mL |
滴定管读数 |
消耗标准NaOH溶液的体积mL |
|
| 初读数 |
末读数 |
|||
| 1 |
20.00 |
0.00 |
19.90 |
19.90 |
| 2 |
20.00 |
0.05 |
|
|
请根据右图(滴定管的局部)读出第2次实验的末读数,
填充上表中的两个空格。
(10分)常温下,如果取0.1mol·L-1的HA溶液与0.1mol·L-1的NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合液的PH=8,试回答以下问题:
(1)混合溶液的PH=8的原因 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1mol·L-1NaOH溶液中由水电离出的c(H+)(填“>”“ <”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四种盐溶液:A、NH4HCO3 B、NH4A C、(NH4)2SO4 D、NH4Cl,按PH由大到小的顺序排列是 (填字母)。
某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2)若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3)若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.