(10分)25 ℃时,硫氢化钾溶液里存在下列平衡:
(a)HS-+H2O
 OH-+H2S
OH-+H2S
(b)HS-
 H++S2-
H++S2-
(1)________是电离平衡;________是水解平衡。
(2)当向其中加入硫酸铜溶液时,生成了CuS沉淀,则电离平衡向________移动;水解平衡向________移动;c(H+)变________(填“大”或“小”)。
(3)当向其中加入氢氧化钠固体时,c(S2-)变________(填“大”或“小”)。
(4)若将溶液加热至沸腾,c(OH-)·c(H+)将变________(填“大”或“小”)。
下列说法是否正确?为什么?
(1)NH3在碱性溶液中比在纯水的溶解度大。
(2)氯化钠和醋酸铵的pH都接近于7,因此它们都没有发生水解。
某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为 。.
在25℃时,若100体积的某强酸以溶液与1体积的某强碱溶液混合后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是的 。
(5分)日常生活中,可用明矾作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: 。为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念, 。
。
(2)中性溶液的AG= 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG= ,由水电离的c(H+)= 。
pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=__________。
(3)某温度(t℃)时,水的KW=10-13,则该温度______25℃(填大于、等于或小于),理由是_________________________________________________;将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,①若所得混合溶液为中性,则a :b =_________;
②若所得混合溶液pH=2,则a :b =__________。
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: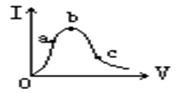
(1)“O”点导电能力为0的理由是
(2)a、b、c三点溶液中c(H+)由大到小的顺序是 (用a、b、c字母表示)
(3)a、b、c三点中醋酸的电离程度最大的是 ;(用a、b、c字母表示)
(4)若使c点溶液中c(CH3COO‑)增大,溶液中c(H+)减小,在如下措施中可选择:
(填序号)
①加热;②加少量NaOH固体;③加水;④加少量CH3COONa固体;⑤少量加冰醋酸
下列各物质的溶液物质的量浓度均为0.1 mol·L-1
①HCl ②NaOH ③ Na2CO3 ④CH3COONa ⑤NH4Cl ⑥Ba(OH)2⑦KCl ⑧ CH3COOH
按它们的pH由小到大的排列的顺序为 (填序号)
(14分)用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1)用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl的pH 7(填“<”、“=”或“>”),显 性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为 ;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为 。
(3)若对NH4Cl溶液进行测定,溶液中浓度最大的是 离子,微粒个数最少的是 离子。
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol。
②_ __和_ 两种粒子的物质的量之和比OH―多0.05mol。
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl⑤(NH4)2CO3的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
(14分)甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加人盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体。
(1) 甲、乙、丙的化学式分别为____________
(2) 250C时,PH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为______。
(3) 写出⑤中发生反应的离子方程式____________
(4) 250C时,将a mol/L CH3COOH溶液与0.02 mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)="______" (忽略混合时溶液体积的变化)。
(5) 等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该
元素的质量相等,则乙溶液和丙溶液的体枳比可能为______ (填选项字母)。
| A.3:1 | B.1:3 | C.7:1 | D.1:7 |
(1)、配制FeSO4溶液时,常加入少量铁粉,目的是___________________________________;常加入少量H2SO4,目的是__________________________________________________。
(2)、泡沫灭火剂包括Al2(SO4)3溶液(约1 mol·L-1)、NaHCO3溶液(约1 mol·L-1)及起泡剂。使用时发生的化学反应的离子方程式是_____________________________。
(3)、已知 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体, 为难溶于水和酸是黑色固体。
为难溶于水和酸是黑色固体。 和
和
水的悬浊液中加入足量的 溶液并振荡,结果白色固体完全转化为黑色固体。
溶液并振荡,结果白色固体完全转化为黑色固体。
①、写出白色固体转化黑色固体的化学方程式: ;
②、白色固体转化成黑色固体的原因是: 。
(4)、已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 |
① AgCl |
② AgBr |
③ Ag2S |
④ Ag2CrO4 |
| Ksp |
2.0×10-10 |
5.4×10-13 |
2.0×10-48 |
2.0×10-12 |
①20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填序号)
_____________________________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=_______________ 。
在常温下,下列五种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L ③0.1mol/L
③0.1mol/L
④0.1mol/L 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L; 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" ) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
在一定温度下,醋酸溶液存在电离平衡:
CH3COOH  CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1mol/L的醋酸溶液中的c(H+) 与0.01mol/L c(H+)的比值 _________________(填“大于”、“小于”或“等于”)10
(2)已知:25℃时,该电离平衡的平衡常数为1.75×10-5
①求该温度时,amol/L的醋酸溶液中c1(H+)="________________mol/L" (用含a的代数式表示)。[提示:此时a比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+) 、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为bmol/L,则此时c2(H+)=________________mol/L(用含a、b的代数式表示).
③c1(H+)__________ c2(H+)(填“大于”、“小于”或“等于”)