(5分)日常生活中,可用明矾作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: 。为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,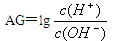 。
。
(2)中性溶液的AG= 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG= ,由水电离的c(H+)= 。
(5分)日常生活中,可用明矾作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: 。为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,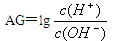 。
。
(2)中性溶液的AG= 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG= ,由水电离的c(H+)= 。