常温下,将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d L其中a、b、c、d的关系正确的是
| A.a=b>d>c | B.a=b>c>d | C.b>a=d>c | D.c>a=d>b |
在T ℃时, Ba(OH)2的稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=4的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
| ① |
22.00 |
0.00 |
8 |
| ② |
22.00 |
18.00 |
c |
| ③ |
22.00 |
22.00 |
d |
假设溶液混合前后的体积变化可忽略不计,则下列说法不正确的是
A.a = 8 B.b = 4 C.c = 5 D.d = 6
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00ml 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

| A.II表示的是滴定醋酸的曲线 |
| B.V(NaOH) =20.00ml时,两份溶液中c(Cl—)=c(CH3COO—) |
| C.pH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| D.V(NaOH) =10.00ml时,醋酸溶液中: 2c(OH—)-2 c(H+ )= c(CH3COO—)- c(CH3COOH) |
液氨与水性质相似,也存在微弱的电离:2NH3 NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
| A.液氨的电离度 | B.液氨的离子积常数 |
| C.c(NH4+) | D.c(NH2-) |
室温下,取溶质的物质的量浓度相同的NaOH溶液和HCl溶液,以体积比3:2相混合,所得溶液的pH=12,则原溶液中溶质的物质的量浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.50mol/L | D.0.05mol/L |
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
下列说法正确的是( )
| A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。 |
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 |
| D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
下列各表述与示意图一致的是( )

| A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B.图②表示一定条件下进行的反应2SO2(g) + O2(g) 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
| C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图④表示化学反应H2(g)+C12(g)==2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如右图所示。下列有关说法不正确的是( )

| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.a、b、c点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.b点:c(M+)+c(MOH)=c(Clˉ) |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是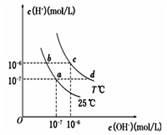
| A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl— |
| B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ |
| D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
把pH=13的NaOH溶液与pH=2的硫酸溶液混合后,所得溶液的pH=11,则NaOH溶液和硫酸溶液的体积之比为
| A.1:1 | B.1:5 | C.1:9 | D.2:3 |
下图所示与对应叙述相符的是( )
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y Z Z |
| B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂 |
| C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C- |
常温下,有下列四种溶液:①pH=2的HCl溶液;②pH=2的CH3COOH溶液;③pH=12的NaOH溶液;④pH=12的氨水。下列有关说法不正确的是( )
| A.四种溶液中的KW相同,由水电离出的c(H+):①=②=③=④ |
| B.取体积相同的溶液①、②、③分别与足量铝粉反应,生成H2的量:①最少 |
| C.将等体积的四种溶液分别稀释100倍,所得溶液的pH:③>④>②>① |
| D.常温下,将②和③等体积混合:c(CH3COO-)-c(Na+)=c(H+)-c(OH-) |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |