某溶液中在25℃时由水电离出的氢离子浓度为1×10-12mol/L,下列说法正确的是
| A.HCO3-离子在该溶液中一定不能大量共存 |
| B.该溶液的pH一定是12 |
| C.向该溶液中加入铝片后,一定能生成氢气 |
| D.若该溶液的溶质只有一种,它一定是酸或碱 |
水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
| A.向水中投入一小块金属钠 | B.将水加热煮沸. |
| C.向水中通入二氧化碳气体 | D.向水中加食盐晶体 |
(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
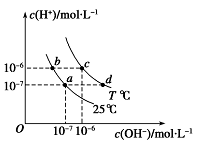
| A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw |
| B.T<25℃ |
| C.b点和c点pH均为6,溶液呈酸性 |
| D.只采用升温的方式,可由a点变成d点 |
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,[H+]减小 |
| C.再加入10mL pH="11" NaOH溶液,混合液pH=7 |
| D.溶液中由水电离出的[H+]=1×10-11 mol·L-1 |
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关该溶液说法错误的是
| A.溶液中所有离子的浓度都减小 | B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 | D.溶液的pH增大 |
已知:25℃时,Mg(OH)2的Ksp=5.61×10﹣12,MgF2的Ksp=7.42×10﹣11,下列判断正确的是( )
| A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
已知醋酸、醋酸根离子在溶液中存在下列平衡:
| CH3COOH+H2O |
C H3COO-+H3O+ |
K1=1.75×10-5 mol·L-1 |
| CH3COO-+H2O |
CH3COOH+OH- |
K2=5.71×10-10 mol·L-1 |


 现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2 同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )

用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
某学生的实验报告所列出的下列数据中合理的是( )
| A.用1mol的醋酸溶液和1.01mol的氢氧化钠溶液做中和热实验测得中和热的数值为57.3kJ/mol |
| B.通过实验得知在常温常压下,12g固体C和32g气体O2所具有的总能量一定大于44g气体CO2所具有的总能量 |
| C.室温下,用广泛pH试纸测得某溶液的pH为2.3 |
| D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.7mL |
某次酸雨的分析数据如下:c(NH4+)=2.0×10—5 mol·L—1,c(Cl —)=6.0×10—5 mol·L—1,c(Na+)= 1.9×10—5 mol·L—1,c(NO3—)=2.3×10—5 mol·L—1,c(SO42—)=2.5×10—5 mol·L—1,则此次酸雨的pH大约为
| A.3 | B.4 | C.5 | D.6 |
水是一种极弱的电解质,在室温下,平均每n个水分子中只有1个水分子发生了电离,则n的值是 ( )
| A.1×10-14 | B.55.6×107 | C.107 | D.55.6 |
已知水在25℃和95℃时,其电离平衡曲线如右图所示,下列说法错误的是
| A.95℃时,pH=4的H2SO4溶液中,由水电离出的c(OH-)=1×10-10mol/L |
| B.15℃时,pH=7的溶液呈酸性 |
| C.AB连线上的点均表示中性溶液 |
| D.B点对应的温度高于A点对应的温度 |
NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是
| A.用图甲所示操作转移NaOH溶液到容量瓶中 |
| B.用图乙所示装置准确称得0.1575gH2C2O4•2H2O固体 |
| C.用图丙所示操作排除碱式滴定管中的气泡 |
| D.用图丁所示装置以NaOH待测液滴定H2C2O4溶液 |