在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列关于离子共存说法中正确的是( )

| A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
| B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe3+ |
| D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
下列溶液均处于25℃,有关叙述正确的是
| A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| B.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C.含有NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.pH=4.5的番茄汁中c(H+) 是pH=6.5的牛奶中c(H+)的100倍 |
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图。有关曲线图的说法正确的是
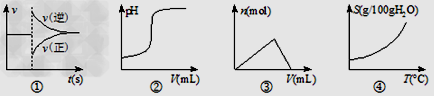
| A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 |
| B.曲线图②可以表示向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时的pH的变化 |
| C.曲线图③可以表示向一定量偏铝酸钠溶液中滴加稀盐酸时产生沉淀的物质的量变化 |
| D.曲线图④可以表示所有的固体物质溶解度和温度的变化 |
用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
| A.试样中加入酚酞作指示剂,用标准酸液进行滴定 |
| B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定 |
| C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行测定 |
| D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定 |
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH=-lgc[OH-])与pH的变化关系如图所示,则
| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)>c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
(1)25℃时,①0.1mol·L-1的醋酸 ②0.1mol·L-1的硫酸 ③0.1mol·L-1的氨水的④0.1mol·L-1的NaOH溶液,其pH由小到大的顺序是 (填序号)

(2)下列物质中①NaCl ②BaSO4 ③稀硫酸 ④KOH ⑤H2O ⑥CH3COOH ⑦NH3 ⑧蔗糖 ⑨SO2 ⑩Cu,其中属于强电解质的有 ;其中属于弱电解质的有 ;其中属于非电解质的有 。
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等。若将两溶液稀释相同的倍数后,pH(A) pH(B) (填“>”、“=”或“<”)。现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A) V(B)(填“>”、“=”或“<”)。
(4)已知:二元酸H2R 的电离方程式是:H2R=H++HR-,HR- R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1
R2- + H+,若0.1 mol·L-1NaHR溶液的c(H+)="a" mol·L-1 ,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
,则0.1mol·L-1H2R溶液中c(H+) (0.1+a) mol·L-1(填“<”、“>”或“=”),理由是 。
(5) 25℃时,若10体积某强碱溶液与1体积的某强酸溶液混合后,溶液的pH=7,则混合前,该强碱溶液的pH(强碱)与强酸溶液pH(强酸)之间应满足的关系是 。
常温下,向100ml0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )

| A.HA为弱酸 |
| B.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OH-)+c(A-) |
| C.K点对应的溶液中:c(M+)+c(MOH)=c(A-) |
| D.常温下,MA溶液的pH>7 |
常温下,下列各组离子在相应的条件下可能大量共存的是
| A.能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ |
B.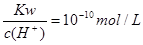 的溶液中:Na+、HCO3-、Cl-、K+ 的溶液中:Na+、HCO3-、Cl-、K+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3- |
| D.由水电离产生的c(OH-)=1×10-12mol/L的溶液中:NO3-、Mg2+、Na+、SO42- |
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)_______0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”) 。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH_____________。(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 |
0.1032mol/L HCl溶液体积/mL |
待测NaOH溶液体积/mL |
| 1 |
27.83 |
25.00 |
| 2 |
26.53 |
25.00 |
| 3 |
27.85 |
25.00 |
①待测NaOH溶液的物质的量浓度为________________mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是____________。
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
1.8×10﹣10 |
5.0×10﹣13 |
8.3×10﹣17 |
2.0×10﹣48 |
1.8×10﹣10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的_________________。
A.KBr B.KI C.K2S D.K2CrO4
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
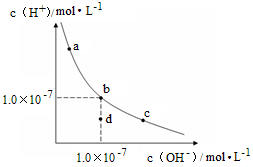
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
A、B、C、D、E五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是__________,(填化学式,下同)E是__________;
(2)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中__________曲线(填写序号).
(3)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为__________.
(4)写出C的稀溶液和足量的D溶液反应的离子方程式______________________。
滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是_________________。
②上述滴定过程中操作滴定管的图示,正确的是____________。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH溶液浓度_________________(填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定——用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,你认为合理的是___________________(填字母符号)。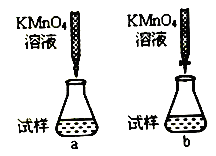
②判断滴定终点的依据是____________。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如下图,则此时消耗标准溶液的体积为______________。
水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。N-H键的键能是_________
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式:① 。
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② 。
(3)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/.
(4)纳米MgO可用于尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
3 |
3:1 |
实验②和④探究a 实验②和b 探究反应时间对产率的影响 |
| ② |
378 |
4 |
4:1 |
|
| ③ |
378 |
3 |
c |
|
| ④ |
398 |
4 |
4:1 |