按要求填写下列相关内容:
(1)在常温下,将体积为VaL、pH为a的稀硫酸和体积为VbL、pH为b的烧碱溶液混合,若所得混合液为中性。如果a+b=15,则Va:Vb=___________。某温度时,水的离子积常数Kw=1×10-13.在此温度下,将pH=a的硫酸溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,如果a+b=12,则Va:Vb=___________。
(2)中和相同体积,相同pH的Ba(OH)2、NH3·H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为______________(用“V1、V2、V3”和“>、<、=”表示)。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸。
①在同体积、同pH的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是___________。(填酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_____________。
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用________或_________来测量得到。
(2)某研究性学习小组用pH=1的盐酸滴定25.00 mL未知物质的量浓度的NaOH溶液,从而求出该NaOH溶液的pH值(选用酚酞作为指示剂)
①实验过程中需要使用的仪器有铁架台、滴定管夹、碱式滴定管、胶头滴管、________、 ,
②右图,是某次滴定时的滴定管中的液面,其读数为 mL;

③如何判断滴定到达终点________________________
④根据下列数据:
| 滴定次数 |
待测液体积(mL)[来源 |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测NaOH溶液的浓度(保留两位小数) mol/L
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有: 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.酸式滴定管尖嘴部分有气泡,滴定后消失
下列反应水解方程式正确的是
| A.AlCl3+3H2O=Al(OH)3+3HCl |
B.Na2CO3+2H2O H2CO3+2NaOH H2CO3+2NaOH |
C.碳酸氢钠溶液:HCO3-+H2O H2CO3+OH— H2CO3+OH— |
D.NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+ NH3·D2O+H+ |
今年入冬以来,银川雾霾天气频繁出现,空气质量很差,严重影响市民的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+ 1/2O2(g) =H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g) =CO(g)△H =-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0。若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g) △H>0。若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,反应方程式为 。
室温下,用0.100 mol·L-1 NaOH溶液分别滴定20.00ml 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

| A.II表示的是滴定醋酸的曲线 |
| B.V(NaOH) =20.00ml时,两份溶液中c(Cl—)=c(CH3COO—) |
| C.pH=7时,滴定醋酸消耗V(NaOH)小于20ml |
| D.V(NaOH) =10.00ml时,醋酸溶液中: 2c(OH—)-2 c(H+ )= c(CH3COO—)- c(CH3COOH) |
T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示

(1)图中a点的值为
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O CH3COOH+OH-的平衡常数K= 。
CH3COOH+OH-的平衡常数K= 。
(4)在T℃时,取pH=2的硫酸溶液0.5Vml稀释到2Vml ,与0.1mol/L的NaOH溶液0.15Vml混合后稀释至10Vml,溶液的pH= 。
将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
| A.c(HCN)<c(CN-) | B.c(Na+)=c(CN-) |
| C.c(HCN)-c(CN-)=c(OH-) | D.c(HCN)+c(CN-)=0.1mol·L-1 |
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再进行测定。
(1)在高温下将 x克钢样中碳、硫转化为CO2、SO2(气体a)。
(2)将气体 a通入测硫装置中(如右图 1),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:____________________________________。
②将①的吸收液稀释至250mL,取1/10该溶液进行滴定,用酸式滴定管取液时赶走气泡的操作是_______________________。
③用c mol/L 标准NaOH溶液滴定取出的溶液,则选择的指示剂为____________,直至加入最后一滴 NaOH 溶液时,溶液颜色____________,即可停止滴定。
④某次滴定前后,NaOH在滴定前溶液的液面在0.30mL处,滴定结束时液面在溶液的液面如图2,其体积读数为____________________。若滴定3次,消耗NaOH溶液体积的平均值为 z mL,则该钢样中硫的质量分数为________________(用 x、c、z表示)。
⑤下列操作会造成测定结果偏高的是______________。
a.水洗后未用标准液润洗碱式滴定管 b.加入 1mL 酸碱指示剂
c.滴定终点时,尖嘴出现气泡 d.滴定终点俯视滴定管的刻度

将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
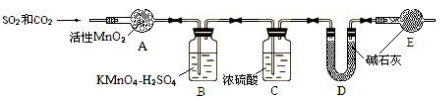
⑥为准确测定 CO2,需除去SO2的干扰,除去 SO2的装置是__________(填序号)。
⑦计算钢样中碳的质量分数,应测量的数据是________。去掉装置 E,测得碳的质量分数_________(填“偏小”、“无影响”或“偏大”)
⑧上述操作中,测定CO2前先除去SO2,但测定SO2前却没除CO2,是否合理?若不合理,说明如何改正;若合理,说明理由________________________。
常温下下列各组离子在指定溶液中能大量共存的是( )
| A.pH=1 的溶液中:Fe2+、NO-3、SO24-、Na+ |
| B.由水电离出的 c(H+)=1×10-14mol/L 的溶液中:Ca2+、Cl-、HCO-3、K+ |
| C.c(H+)/c(OH-)=1×1012的溶液中:NH+4、Cl-、NO-3、Al3+ |
| D.c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN- |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
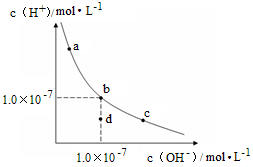
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
A、B、C、D、E五种溶液分别是NaOH溶液、氨水、醋酸、盐酸、NH4HSO4溶液的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是__________,(填化学式,下同)E是__________;
(2)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中__________曲线(填写序号).
(3)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为__________.
(4)写出C的稀溶液和足量的D溶液反应的离子方程式______________________。
滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①酸式滴定管、碱式滴定管、温度计、量筒、玻璃棒、烧杯。若要进行中和滴定实验,还缺少的玻璃仪器是_________________。
②上述滴定过程中操作滴定管的图示,正确的是____________。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得NaOH溶液浓度_________________(填“偏大”、“偏小”或“无影响”)。
(2)氧化还原滴定——用标准高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液。
①课外小组里有位同学设计了下列两种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,你认为合理的是___________________(填字母符号)。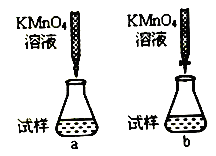
②判断滴定终点的依据是____________。
③某次滴定时记录滴定前滴定管内液面读数为0.50mL,滴定后液面如下图,则此时消耗标准溶液的体积为______________。
水溶液中的行为是中学化学的重要内容。
(1)25 ℃时,某溶液中由水电离出c(H+)=1×10-10 mol/L,该溶液pH为_______________。
(2)25 ℃时,测得亚硫酸氢钠溶液的pH<7,解释该溶液显酸性的原因(用离子方程式表示,并作适当解释) 。
(3)电离常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| HClO |
K=3×10-8 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
25 ℃时,将浓度相同的四种盐溶液:① NaCN ② NaClO ③ Na2CO3 ④ NaHCO3,按pH由大到小的顺序排列 (填序号),向84消毒液中通入少量的CO2,该反应的化学方程式为 。
(4)25 ℃时,将n mol·L-1的氨水与0.2mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______________性(填“酸”、“碱”或“中”), NH3·H2O的电离常数Kb=_____________(用含n的代数式表示)。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。N-H键的键能是_________
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式:① 。
已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式② 。
(3)某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/.
(4)纳米MgO可用于尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
3 |
3:1 |
实验②和④探究a 实验②和b 探究反应时间对产率的影响 |
| ② |
378 |
4 |
4:1 |
|
| ③ |
378 |
3 |
c |
|
| ④ |
398 |
4 |
4:1 |
用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00 mL待测液应使用________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视____________;判断到达滴定终点的依据是:________。
(4)以下是实验数据记录表

从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.锥形瓶用待测液润洗 |
| C.NaOH标准液保存时间过长,有部分变质 |
| D.滴定结束时,俯视计数 |
(5)根据表中记录数据,通过计算可得,该盐酸浓度为:____________mol/L