25℃时,部分物质的电离常数如表所示:
请回答下列问题:
(1)同浓度的a.CH3COO-,b.HCO3-,c.CO32-,d.ClO﹣结合H+的能力由强到弱的顺序为__________(填编号)。
(2)向NaClO溶液中通入少量的CO2,反应的离子方程式为__________。
(3)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是__________(填编号)。
(4)常温下0.1mol•L﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是__________(填序号)。
| A.c(H+) | B.c(H+)/c(CH3COOH) |
| C.c(H+)•c(OH﹣) | D.c(H+)•c(CH3COO﹣)/c(CH3COOH) |
若该溶液升高温度,上述5种表达式的数据增大的是__________。
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数______(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
25℃时,水的电离达到平衡:H2O H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如下图所示。下列说法正确的是( )
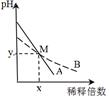
A.稀释前,c(A)>10 c(B)
B.中和等浓度等体积的盐酸时,B用的体积较多
C.M点时A和B的浓度相等
D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是( )
| A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 |
| B.锥形瓶用蒸馏水洗净后,加入一定体积的未知浓度的NaOH溶液润洗 |
| C.滴定时,没有逐出滴定管下口的气泡 |
| D.读数时,视线与滴定管内液体的凹液面最低处保持水平 |
(Ⅰ)某温度下,NaCl溶液中的c(H+)=2.0×10-7 mol/L,则此时在溶液中:
(1)由水电离产生的c(OH-)= ;
(2)若温度不变,滴入稀硫酸使c(H+)=5.0×10-6 mol/L,则c(OH-)= 。
(Ⅱ)(3)某温度下水的离子积为KW =1×10-13,则该温度(填“大于”、“等于”或“小于”)
25℃。
若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过填写以下不同情况时两种溶液的体积比:
(4)若所得混合液为中性,则a∶b= ;
(5)若所得混合液的pH=2,则a∶b= ;
(6)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,若测定结果偏高,其原因可能是 。
| A.配制标准溶液的固体NaOH中混有KOH杂质 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
在标有“20℃,25mL”的滴定管内装溶液至刻度“0”时,管内液体的体积
| A.约为5mL | B.大于25mL | C.等于25mL | D.小于25mL |
将0.2mol/L HCN溶液和0.1mol/L NaOH溶液等体积混合后溶液呈碱性,下列关系式中不正确的是
| A.c(HCN) >c(CN—) | B.c(Na+)>c(CN—) |
| C.c(HCN)-c(CN—)=c(OH—) | D.c(HCN)+c(CN—)=0.1mol/L |
填空
(1)、甲溶液的pH是2,乙溶液的pH是4,求甲溶液和乙溶液的c(H+)之比为 。
(2)、电解饱和食盐水时,阴极析出气体是 (填化学式)。
(3)、现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是 。(结合离子反应方程式说明)
(4)、已知25℃时,醋酸和亚硫酸的电离平衡常数:醋酸K=1.75×10-5 ,亚硫酸K1=1.54×10-2、
K2=1.02×10-7。则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH H2SO3(填>、<或=)。
(5)、向明矾溶液中逐滴加入Ba(OH)2溶液,若加至铝离子刚好完全沉淀,请写出反应的离子反应方程式: 。
(6)、炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请写出铁锅腐蚀正极的电极反应式: 。
某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(1)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250 mL 溶液,
(2)用 0.2000 mol·L-1标准盐酸滴定待测烧碱溶液,实验操作如下
| A.用碱式滴定管取上述烧碱溶液10.00 mL,注入锥形瓶中,加入指示剂。 | B.用待测定 的溶液润洗碱式滴定管。 | C.用蒸馏水洗干净滴定管。 | D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~ 3 cm处,再把酸式滴定管固定好, 调节液面至刻度“0”或“0”刻度以下。E.检查滴定管是否漏水。F.另取锥形瓶,再重复 操作一次。G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度。 |
①滴定操作的正确顺序是(用序号填写):________________
②该滴定操作中应选用的指示剂是:________________
③在G操作中如何确定终点?________________
(3)数据处理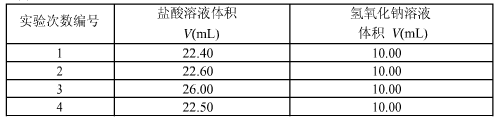
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为__________,烧碱的纯度为_________。
(4)下列操作,会导致实验结果偏低的是________(填序号)。
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗
欲用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,下列有关说法正确的是
| A.滴定管在装溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| B.锥形瓶在装待测溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| C.滴定过程中,两眼注视滴定管装液面的变化 |
| D.装标准液的滴定管中有气泡而滴定前未排出,则滴定结果将偏低 |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |