根据表中信息判断,下列选项不正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4 ...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+
某溶液中含有的溶质是FeBr2、FeI2 ,若先向该溶液中通人一定量的氧气.再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;
②通人氮气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的落液中是否存在;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D①②③④。
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸(HClO2为弱酸)不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始时HClO2分解反应反应缓慢,随后反应迅速,其原因是
| A.在酸性条件下,亚氯酸钠的氧化性增强 |
| B.溶液中的Cl-起催化作用 |
| C.ClO2逸出,使反应的生成物浓度降低 |
| D.溶液中的H+起催化作用 |
9.下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12 |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+ H2O |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2 O2+6 H+ |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO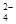 +H++OH- +H++OH- |
已知I2+SO32-+H2O===SO42-+2I-+2H+。某无色溶液中只可能含有I-,NH4+,Ba2+, SO32-,MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是
| A.该溶液中肯定不含I- | B.该溶液中可能含有Ba2+ |
| C.该溶液中肯定含有NH4+ | D.该溶液中可能含有MnO4- |
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。
已知①BrO3-+6I一+6H+=3I2+Br-+3H2O;②2BrO3- +I2 = 2IO3-+ Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由 。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。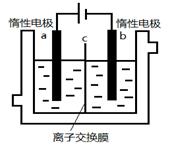
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 。
根据下列反应判断有关的物质氧化性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3.
| A.H2SO3>I﹣>Fe2+>NO | B.HNO3>Fe3+>I2>H2SO4 |
| C.HNO3>Fe3+>H2SO3>I2 | D.NO->Fe2+>H2SO3>I﹣ |
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。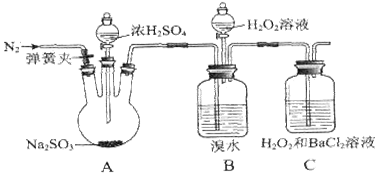
| 实验操作 |
实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是_______________________
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是_____________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO42-,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
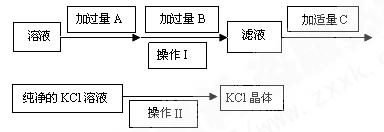
(1)上述试剂中,B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种。为了确定溶液的组成,进行了如下操作:

(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如表所示,回答下列问题:
| Cl2的体积(标况下) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5 mol |
2 mol |
| n(Br-) |
1.5 mol学] |
1.4mol |
0.9 mol |
| n(I-) |
a mol |
0 |
0 |
①则a为
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,关于该反应的说法中不正确的是
| A.M为H2O |
| B.SnCl62-是氧化产物 |
| C.还原性:As>SnCl2 |
| D.每生成1molAs,反应中转移电子的物质的量为3mol |
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
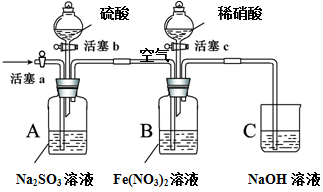
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序为( )
①I2 + SO2 + 2H2O =H2SO4 + 2HI ②2FeCl2 + Cl2 = 2FeCl3
③2FeCl3 + 2HI =2FeCl2 + I2 + 2HCl
| A.I-> Fe2+>Cl->SO2 | B.Cl-> Fe2+> SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I-> Fe2+>Cl- |
根据表中信息判断,下列选项正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4…… |
| ② |
C12、FeBr2 |
FeC13、FeBr3 |
| ③ |
MnO4-…… |
C12、Mn2+…… |
A.第①组反应的其余产物为H2O、MnSO4
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2
已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)。
2H++ 2CrO42-(黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42-+ 4H2O
下列分析正确的是
| A.CrO42-和S2-在酸性溶液中可大量共存 |
| B.实验②说明氧化性:Cr2O72->SO42- |
| C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
| D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |