已知电离平衡常数:H2CO3>HClO>HCO,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O="5" Br-+ BrO3-+6HCO3-
| A.②④ | B.①③ | C.②③ | D.①④ |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是两性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
(8分)为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验).
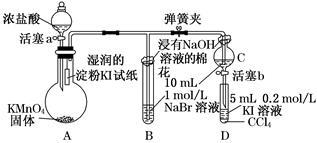
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________.
(2)验证氯气的氧化性强于碘的实验现象是________________.
(3)B中溶液发生反应的离子方程式是__________________________.
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是____ ____.
(5)过程Ⅲ实验的目的是___ _ __.
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减弱.
(14分)NaClO具有强氧化性,其溶液可用于游泳池及环境消毒。
(1)已知:
①Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l) △H=-101.1kJ·mol-1
②3NaClO(aq)=2NaCl(aq)+NaClO3(aq) △H=-112.2kJ·mol-1
则3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(l) △H=
(2)工业上可用石墨电极电解饱和氯化钠溶液制取次氯酸钠溶液装置如图所示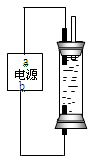
①电源中,a电极名称是
②用此装置电解热的氯化钠溶液时会有部分氯酸钠生成,若电解消耗了117g氯化钠时,电路中共转移的电子为8mol,则次氯酸钠的产率为
(3)向次氯酸钠溶液通入少量的CO2,只生成次氯酸钠和碳酸氢钠,则相同温度下,等物质的量浓度的Na2CO3、NaClO、NaHCO3溶液的pH由大到小的顺序为 。
(4)向盛有硫酸酸化的淀粉KI溶液的试管中,滴加少量次氯酸钠溶液,会立即观察到溶液变成蓝色,该反应的离子方程式为 。再向上述的蓝色溶液中,继续滴加Na2SO3溶液,又发现蓝色溶液逐渐褪色,该反应的化学方程式为 。对比上述两组实验所得结果,比较ClO― 、I2、SO42― 三种微粒氧化性由强到弱的顺序 。
(13分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: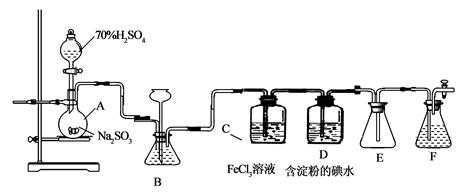
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若
,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
| A.蒸馏水 | B.饱和Na2SO3溶液 |
| C.饱和NaHSO3溶液 | D.饱和NaHCO3溶液 |
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是_________________,写出有关离子方程式:_____________。
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为
A.I2、H2O2、KMnO4、NaBiO3 B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2 D.KMnO4、NaBiO3、I2、H2O2
稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易被氧化变暗,且受热易燃烧,遇水很快反应。下列说法正确的是(已知:铈常见的化合价有+3和+4,氧化性:Ce4+>Fe3+)
| A.电解熔融CeO2制Ce时,铈在阳极获得 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ |
D.Ce有四种稳定的核素嚣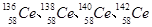 ,它们互称为同位素 ,它们互称为同位素 |
金属铈(稀土元素)性质活泼。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
| A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI ="=" CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + Fe2+ = Ce3+ + Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阳极获得铈 |
D.四种铈的核素 Ce、 Ce、 Ce、 Ce、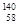 Ce、 Ce、 Ce,它们互称为同素异形体 Ce,它们互称为同素异形体 |
已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)。
2H++ 2CrO42-(黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42-+ 4H2O
下列分析正确的是
| A.CrO42-和S2-在酸性溶液中可大量共存 |
| B.实验②说明氧化性:Cr2O72->SO42- |
| C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
| D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
某小组同学为比较酸性条件下ClO-、S、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去)。
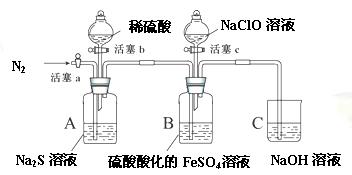
实验步骤及现象记录如下(每步操作进行前均通一段时间N2,排出装置内原有气体。):
1、打开活塞c,向装置B滴加次氯酸钠溶液,溶液立即变为黄色,一段时间后观察到装置B中液面上方出现黄绿色气体时,立即关闭活塞c。
2、用注射器取出少量装置B中的溶液,滴加几滴KSCN溶液,溶液变为血红色。
3、打开活塞b,向装置A中加入足量稀硫酸后,关闭活塞b,观察到装置B中溶液变浑浊。
4、一段时间后,用注射器取出少量装置B中的上层清液,……
请回答下列问题:
(1)在添加药品前需进行的操作是 。
(2) 步骤1中,发生反应的离子方程式是 , 。
(3)步骤3中导致浑浊的物质是 。
(4) 步骤4是为了验证该溶液中存在的金属阳离子只有Fe2+。甲同学认为后续操作应是滴加酸性KMnO4溶液,但乙同学认为该方法不妥,原因是 ;合理的操作及实验现象应该是 。
(5)分析实验现象,可得出该实验的结论是 。
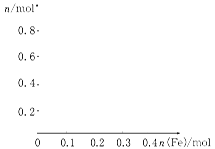
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
某小组同学为了探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
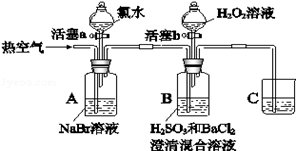
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可): 。
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
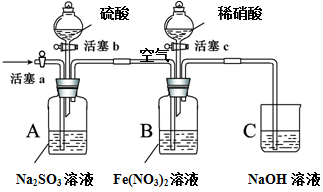
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
化学方程式可简明地体现元素及其化合物的性质。已知氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是( )
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,关于该反应的说法中不正确的是
| A.M为H2O |
| B.SnCl62-是氧化产物 |
| C.还原性:As>SnCl2 |
| D.每生成1molAs,反应中转移电子的物质的量为3mol |