化学方程式可简明地体现元素及其化合物的性质。已知氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH= 2Fe(OH)3 + 2KI; 3I2 + 6KOH=" 5KI" + KIO3 + 3H2O
复分解反应:2HSCN + K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4 NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是( )
| A.氧化性(酸性溶液):FeCl3 > Co(OH)3> I2 |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.酸性(水溶液):HSCN > H2CO3 > HCN |
已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)。
2H++ 2CrO42-(黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42-+ 4H2O
下列分析正确的是
| A.CrO42-和S2-在酸性溶液中可大量共存 |
| B.实验②说明氧化性:Cr2O72->SO42- |
| C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
| D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
过氧化氢H2O2,(氧的化合价为-1价),水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~F涉及H2O2的反应,回答相关问题:
| A.Na2O2 +2HCl=2NaCl+H2O2 |
| B.2H2O2=2H2O+O2↑ |
| C.Ag2O+H2O2=2Ag+O2↑+ H2O |
| D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O |
E.H2O2+MnSO4=MnO2 + H2SO4 F.H2O2 +2 Fe2+ +2H+=2Fe3+ +2H2O
(1)上述反应属于氧化还原反应的是(填代号)_____________。
(2)H2O2仅体现氧化性的反应是(填代号) 。
(3)H2O2仅体现还原性的反应是(填代号) 。
(4)上述反应说明H2O2、Ag2O、MnO2氧化性由强到弱的顺序是: 。
根据表中信息判断,下列选项不正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2 、H2SO4 |
K2SO4 、MnSO4 ...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- ...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+
某小组同学为比较酸性条件下ClO-、S、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去)。
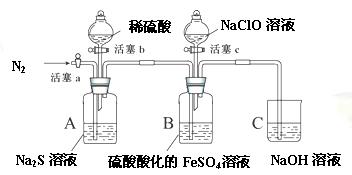
实验步骤及现象记录如下(每步操作进行前均通一段时间N2,排出装置内原有气体。):
1、打开活塞c,向装置B滴加次氯酸钠溶液,溶液立即变为黄色,一段时间后观察到装置B中液面上方出现黄绿色气体时,立即关闭活塞c。
2、用注射器取出少量装置B中的溶液,滴加几滴KSCN溶液,溶液变为血红色。
3、打开活塞b,向装置A中加入足量稀硫酸后,关闭活塞b,观察到装置B中溶液变浑浊。
4、一段时间后,用注射器取出少量装置B中的上层清液,……
请回答下列问题:
(1)在添加药品前需进行的操作是 。
(2) 步骤1中,发生反应的离子方程式是 , 。
(3)步骤3中导致浑浊的物质是 。
(4) 步骤4是为了验证该溶液中存在的金属阳离子只有Fe2+。甲同学认为后续操作应是滴加酸性KMnO4溶液,但乙同学认为该方法不妥,原因是 ;合理的操作及实验现象应该是 。
(5)分析实验现象,可得出该实验的结论是 。
某小组同学为了探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
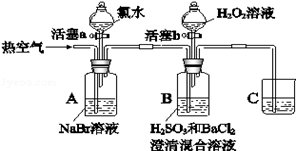
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可): 。
已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=KCl+3Cl2↑+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为6:1 |
| D.反应③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
向CuSO4溶液中逐滴加入 KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通人 SO2气体,溶液逐渐变成无色。下列分析正确的是( )
| A.滴加KI溶液时,转移2 mol e— 时生成 1 mol白色沉淀 |
| B.通入SO2后溶液逐渐变成无色,体现了 SO2的漂白性 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2> SO2 |
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+ 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72- > Fe3+ |
| C.CrO42- 和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
根据表中信息判断,下列选项正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
C12、FeBr2 |
FeC13、FeBr3 |
| ③ |
MnO4-… |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成1mol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法错误的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
| 实验步骤、预期现象 |
结论 |
| ①向溶液中加入四氯化碳,操作 现象 |
假设1正确 |
| ②向溶液中另入 现象 |
假设2正确 |
若假设1正确,从实验①分离出Br2的实验操作名称是
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
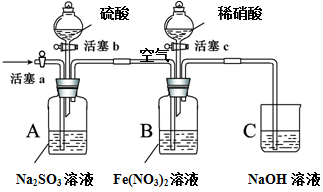
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)实验I中,发生反应的离子方程式是 。
(2)实验IV的后续操作是 ,观察到的现象是 。
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是 。
(4) 实验操作V的目的是 。
(5)实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是 。
铋(Bi)位于元素周期表中ⅤA族,+3价较稳定,铋酸钠(NaBiO3)溶液呈无色。取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
| 加入溶液 |
①适量的铋酸钠溶液 |
②过量的双氧水 |
③适量KI淀粉溶液 |
| 实验现象 |
溶液呈紫红色 |
紫红色消失,产生气泡 |
溶液变成蓝色 |
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱(从左至右)的顺序为
A.NaBiO3、KMnO4、H2O2、I2
B.I2、H2O2、KMnO4、NaBiO3
C.KMnO4、NaBiO3、I2、H2O2
D.H2O2、I2、NaBiO3、KMnO4
某学生做如下实验:第一步,在淀粉-KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是
| A.氧化性:ClO->I2>SO42- |
| B.若将Na2SO3溶液加入氯水中,氯水褪色 |
| C.淀粉-KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 |
| D.蓝色消失的原因是Na2SO3溶液具有漂白性 |