糖生物电池是一种酶催化燃料电池(EFC),它使用便宜的酶代替贵金属催化剂,利用空气氧化糖类产生电流。下列有关判断不合理的是
A.该电池不宜在高温下工作
B.若该电池为酸性介质,正极反应式为:O2+4e-+4H+=2H2O
C.放电过程中,电池内阳离子向正极迁移
D.若该电池为碱性介质,以葡萄糖为原料并完全氧化,负极反应式为:C6H12O6-24e-+6H2O=6CO2↑+24H+
氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2 + 4OH— - 4e— ="=" 4H2O O2 + 2H2O + 4e— ="=" 4OH—
据此作出判断,下列说法中错误的是
| A.H2在负极发生氧化反应 |
| B.供电时总反应为:2H2 + O2 ="=" 2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |
下列关于充电电池的叙述,不正确的是
| A.充电电池的化学反应原理是氧化还原反应 |
| B.充电电池可以无限制地反复放电、充电 |
| C.充电是使放电时的氧化还原反应逆向进行 |
| D.较长时间不使用电器时,最好从电器中取出电池,并妥善存放。 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.图为RFC工作原理示意图,有关说法正确的是
A. 当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e﹣=2H2↑+4OH﹣
C. d极上发生的电极反应是:O2+4H++4e﹣=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
某研究小组提出了一种新的设想:利用原电池原理,设计一种H2、Cl2燃料电池,原电池总反应为:H2+Cl2=2HCl,在对外提供电能的同时还可得到工业上具有重要用途的较浓的盐酸。他们设计的原电池装置如下,其中两个电极均为多孔铂电极。下列有关叙述不正确的是
| A.a为负极,通入的气体为氢气 |
| B.正极的电极反应式为:Cl2+2e-=2Cl- |
| C.电流由b极流出,经外电路到a极 |
| D.原电池内部,H+移向负极,Cl-移向正极 |
大功率的镍氢电池使用在油电混合动力车辆中。镍氢电池NiMH电池正极板材料为NiOOH,负极板材料为吸氢合金,下列关于该电池的说法中正确的的是
| A.放电时电池内部H+向负极移动 |
| B.充电时,将电池的负极与外接电源的正极相连 |
| C.充电时阳极反应为Ni(OH)2+ OH-- e-=NiOOH+H2O |
| D.放电时负极的电极反应式为MHn-ne-= M+nH+ |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
绿色电源“二甲醚-氧气燃料电池”的工作原理如下图,所示下列说法正确的是
| A.氧气应从c处通入,电极Y上发生的反应为:O2+4e-+2H2O = 4OH- |
| B.电池在放电过程中,电极X周围溶液的pH增大 |
| C.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O -12e-+3H2O=2CO2+12H+ |
| D.当该电池向外电路提供2 mol电子时消耗O2约为22.4 L |
下列说法正确的是
| A.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
B.原子核内有10个中子的氧原子 |
| C.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| D.新制饱和氯水在光照下有气泡产生,其主要成分是氯气 |
铅蓄电池的反应原理为:2PbSO4+2H2O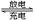 Pb+PbO2+2H2SO4,下列叙述中,正确的是
Pb+PbO2+2H2SO4,下列叙述中,正确的是
| A.PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B.放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C.放电时,当有2 mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D.充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb下列有关说法正确的是:(Pb的相对原子质量:207)
| A.正极反应式:Ca+2Cl- - 2e-=CaCl2 |
| B.常温时,在正负极间接上电流表或检流计,指针不偏转。 |
| C.放电过程中,Li+向负极移动 |
| D.每转移0.1mol电子,理论上生成20.7gPb |
有一种基于乙醇酸性燃料电池原理设计的酒精检测仪,其原理是通过将乙醇氧化为乙酸来测定血液中乙醇的含量。下列有关说法正确的是
| A.电池工作时消耗5.6 L O2,转移电子为1 mol |
| B.检测时,电解质溶液中的H+向负极移动 |
| C.正极上发生的反应为:O2+4e-+2H2O=4OH- |
| D.负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在
其中自由移动。下列有关叙述正确的是
| A.电极a是正极,电极反应式为CH4+4O2--8e-=CO2+2H2O |
| B.电极b是正极,O2-由电极b流向电极a |
| C.瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D.当电路中有0.4mol电子转移时,a极有2.24L(标况)甲烷放电 |
用酸性氢氧燃料电池(甲池)为电源进行电解的实验装置(乙池,一定条件下可实现有机物的电化学储氢)如下图所示.甲池中C为含苯的物质的量分数为10%的混合气体,D为l0mol混合气体其中苯的物质的量分数为24%(杂质不参与反应),E为标准状况下2. 8mol气体(忽略水蒸汽),下列说法正确的是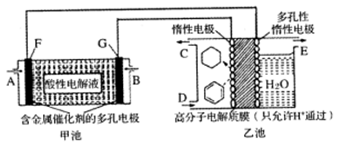
| A.甲池中A处通入H2,E处有O2放出 |
| B.甲池中H+由F极移向G极 |
| C.乙池中阴极区只有苯被还原 |
| D.导线中共传导11.2mol电子 |