我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐。下列说法正确的是
| A.a为正极 |
| B.左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ |
| C.若右池产生0.672L气体(标况下),则转移电子0.15mol |
| D.左池消耗的苯酚与右池消耗的NO3-的物质的量之比为28:5 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+4OH- 2CO32- +6H2O,有关说法正确的是
2CO32- +6H2O,有关说法正确的是
| A.充电时化学能转化为电能 |
| B.放电时,负极电极反应式为:CH3OH + 8OH-- 6e-=CO32- + 6H2O |
| C.标况下,通入的11.2L氧气完全反应有1mol电子转移 |
| D.充电时电解质溶液的碱性逐渐减小 |
美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法正确的是
| A.a极为电池的负极,乙醇被还原 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:2H+ + O2 + 4e-= H2O |
| D.电池工作时1mol乙醇被氧化时,就有12mol质子 |
某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是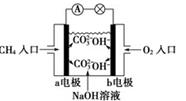
| A.a极是负极,发生氧化反应 |
| B.正极的电极反应是:O2+2H2O+4e-=4OH- |
| C.该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O |
| D.甲烷燃料电池是环保电池 |
右图是一种正在投入生产的大型蓄电系统的原理图。电池的中间为只允许钠离子通过的离子选择性膜。电池充、放电的总反应方程式为:2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
下述关于此电池说法正确的是
| A.充电的过程中当O.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 |
| B.电池放电时,负极反应为:3NaBr一2e-=NaBr3+2Na |
| C.充电过程中,电极a与电源的正极相连 |
| D.放电过程中钠离子从右到左通过离子交换膜 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O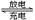 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
关于该电池的说法正确的是
| A.放电时,Zn作负极,发生还原反应 |
| B.放电时,K2FeO4附近溶液pH减小 |
| C.充电时,锌极附近溶液pH减小 |
| D.充电时,阳极电极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
| A.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池内部H+由正极向负极移动 |
有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成燃料电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
| A.每消耗1molCH4可以向外电路转移4mol电子 |
| B.负极上CH4失去电子,电极反应式为CH4+10OH—=CO32—+7H2O+8e— |
| C.负极上是O2获得电子,电极反应式为:O2+2H2O+4e—=4OH— |
| D.电池放电后,溶液pH不断升高 |
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构如下图:
以下选项两栏内容正确且相关联的是
| 选项 |
操作与现象 |
解释与推论 |
| A |
电池放电时化学能转化为电能 |
Zn(s) + Cu2+(aq) = Zn2+ + Cu(s) △H>0 |
| B |
该电池充电时铜棒变细 |
两电极区溶液颜色都变深 |
| C |
该电池放电时铜棒是电池正极 |
Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D |
该电池充电时a接电源正极 |
电极反应Cu2++2e- = Cu |
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图。下列说法正确的是
| A.此电池在常温时也能工作 |
| B.正极电极反应式为:O2+2CO2+4e﹣=2CO32﹣ |
| C.CO32﹣向正极移动 |
| D.a为CH4,b为CO2 |
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:
CH3CH2OH+O2=CH3COOH+H2O。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则消耗2.24L氧气 |
| C.正极上发生还原反应,负极上发生氧化反应 |
| D.负极上的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
镁—次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg +ClO - +H2O ="=" Mg(OH)2+ Cl-下列有关说法正确的是
| A.电池工作时,C溶液中的溶质是MgCl2 |
| B.电池工作时,正极a附近的pH将不断增大 |
| C.负极反应式:ClO -—2e - +H2O ="=" Cl- + 2OH- |
| D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.1mol Cl- |
微型纽扣电池在现代生活中是广泛应用的一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应式分别为:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,电池总反应式为Ag2O+Zn===2Ag+ZnO。根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液pH增大 |
| B.在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| D.外电路中每通过0.2 mol电子,正极的质量理论上减小1.6 g |