甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO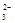 +6H2O.则下列说法正确的是
+6H2O.则下列说法正确的是
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ |
C.由于CO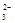 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 |
| D.电池放电时每消耗1molCH3OH转移6mol电子 |
新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )

A.电极B为正极,纳米MnO2层的作用是提高原电池的工作效率
B.放电过程中,Na+从正极区向负极区迁移
C.电池负极的电极反应为:BH4-+8OH--8e-═BO2-+6H2O
D.在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12mol
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )

| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O 2 →2CO 2+ 3H2O.下列说法不正确的是( )
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量不变 |
| D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A.锂离子电池放电时电池反应为LiMO2+C6Li1-x=C6Li+Li1-xMO2 |
| B.锂离子电池充电时电池内部Li+向负极所连的电极移动 |
| C.锂离子电池放电时电池内部电流从负极流向正极 |
| D.锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-=C6Li |
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为: 4VB2 + 11O2→4B2O3 + 2V2O5。下列说法正确的是( )

| A.电极a为电池负极 |
| B.VB2中V的化合价为+4价 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−-22e−=V2O5 + 2B2O3 + 11H2O |
镁-空气电池的工作原理如右图所示。下列说法不正确的是( )

| A.工作一段时间后,c(Na+)变大 | B.电池工作时,OH-向a极移动 |
| C.气体X 中N2的百分含量与空气相同 | D.电池总反应为2Mg+O2+2H2O=2Mg(OH)2 |
观察下列几个装置示意图,有关叙述不正确的是( )

| A.装置①中阴极上析出红色固体 |
| B.装置②的待镀铁制品应与电源负极相连 |
| C.装置③中a为负极,发生的电极反应式为H2+2OH﹣+2e﹣=2H2O |
| D.装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。下列说法正确的是( )

A.B区的OH-通过隔膜向a电极移动,A区pH增大
B.图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C.c是正极,电极上的电极反应为:2H++2e-=H2↑
D.当有1mol电子转移时,b电极产生气体Y的体积为11.2L
以葡萄糖为燃料的微生物燃料电池示意图如图所示。
关于该电池的叙述正确的是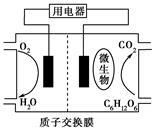
| A.该电池能够在高温下工作 |
| B.电池的负极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体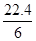 L L |
科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O 2I2+4LiOH
2I2+4LiOH
对于该电池的下列说法不正确的是
| A.放电时负极上I-被氧化 |
| B.充电时Li+从阳极区移向阴极区 |
| C.充电时阴极反应为LiOH+e-==Li+OH- |
| D.放电时正极反应为O2+2H2O+4Li++4e-==4LiOH |
由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使在过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是( )

| A.石墨I极为正极,石墨II极为负极 |
| B.Y的化学式可能为NO |
| C.石墨I极的电极反应式为NO2+NO3――e-═N2O5 |
| D.石墨II极上发生氧化反应 |