(共14分)乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
回答下列问题:
(1)NH4HCO3盛放在装置 中(填字母),该装置中涉及的主要反应的离子方程式 _
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是 _
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。铁粉的作用是 。反应结束后,无需过滤,除去过量铁粉的方法是 _
(4)该兴趣小组用KMnO4法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70mL。滴定反应如下:
Ce4++Fe2+=Ce3++Fe3+
则产品中乳酸亚铁的质量分数为 _
下图为中学化学实验中的常见实验装置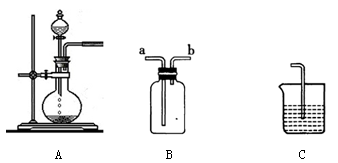
(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 |
O2 |
CO2 |
HCl |
| 试剂 |
|
|
|
(2)装置B可用于收集多种气体,若要用于收集Cl2,则进气管为________;若要收集CO,简述用装置B收集CO的方法________________________________
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 |
该装置中反应的离子方程式 |
| |
|
| |
|
| |
|
| |
|
利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下: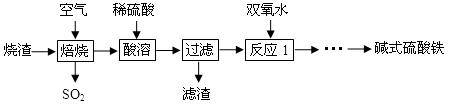
(1)SO2与过量NaOH溶液反应的离子方程式为 。
(2)滤渣的主要成分为 (填化学式)。
(3)反应1中加双氧水的目的是 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。
选考【化学——选修2:化学与技术】
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO3-并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g·L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_____,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+ 3HSO3-=3SO42-+3H+ + I-,则第二步反应的离子方程式为_____________________________
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
| 实验编号 |
0.02mol/LNaHSO3溶液/mL |
0.02mol/LKIO3溶液/mL |
H2O/mL |
反应温度/℃ |
溶液变蓝的时间t/s |
| ① |
15 |
20 |
10 |
15 |
t1 |
| ② |
a |
30 |
0 |
15 |
t2 |
| ③ |
15 |
b |
c |
30 |
t3 |
实验①②是探究______________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________________________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
| |
|
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取20 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取4 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________,检验是否存在该杂质的方法是____________________________。该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:_____________________________。
Ⅱ.测定产率
将所得产品配成500ml溶液,取该溶液20ml,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O62-+2I-
(5)滴定至终点时,溶液颜色的变化:____________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL,则该实验的产率为_____。(保留三位有效数据)
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为_______________________________________。
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是________>__________>__________。
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为_______________。
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式______________。
②工业生产时需在反应物中加少量Cl-,其作用是________________。
③生产中会发生副反应ClO3-+Cl-+H+-Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为____________。
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置___________;
②C中应装的试剂为____________。C中发生反应的化学方程式为:________________。
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下:
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式 。
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4 + H2O = Fe(OH)3↓ + KOH +
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是 。