湖北省武汉华中师大附高一上学期期末化学试卷
下列说法中不正确的有
①火灾现场有大量活泼金属存放时,用水灭火
②铝盐、铁盐有净水作用,向浑浊的水中加入少量明矾或硫酸铁溶液,搅拌,过一段时间,
水的底部会出现很多絮状不溶物,水变澄清透明
③地球上存在的天然二氧化硅形态有结晶形和无定形两大类,统称硅石
④常温下,将氯气通入NaOH溶液中可以得到以次氯酸钠(NaClO)为有效成分的漂粉精
⑤氯化物在化学工业领域有重要应用,例如SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗和钛
的重要中间物质
| A.0项 | B.1项 | C.2项 | D.3项 |
实验室制备Al(OH)3沉淀,最适宜的方法是
| A.AlCl3溶液中加入NaOH溶液 | B.AlCl3溶液中加入足量的氨水 |
| C.NaAlO2溶液中加入浓盐酸 | D.Al2O3溶于足量的热水中 |
某溶液中含有HCO3-、SO32-、CH3COO-、CO32-四种离子,若向其中加入Na2O2后,溶液
中离子浓度基本保持不变的是
| A.HCO3- | B.SO32- | C.CH3COO- | D.CO32- |
下列各组离子因发生氧化还原反应而不能大量共存的是
| A.H+、Fe2+、NO3-、SO42- | B.Al3+、NO3-、SO42-、AlO2— |
| C.OH-、HCO3—、Cl-、K+ | D.Fe3+、K+、SCN-、Cl- |
为除去括号内的少量杂质,所选用的试剂或方法不正确的是
| A.Na2CO3溶液(NaHCO3),加入适量的NaOH溶液 |
| B.NaHCO3溶液(Na2CO3),通入过量的CO2气体 |
| C.CO2气体(HCl气体),通过饱和的Na2CO3溶液 |
| D.SiO2(H2SiO3),加热 |
在甲、乙、丙、丁四个烧杯内分别放入0.1 mol钠、氧化钠、过氧化钠和氢氧化钠,然后各加
入100 mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数的大小顺序为
| A.甲<乙<丙<丁 | B.丁<甲<乙=丙 |
| C.甲=丁<乙=丙 | D.丁<甲<乙<丙 |
下列各种叙述中,正确的是
①Cl-和Cl2的性质相同 ②ClO-具有氧化性 ③Cl-比Cl多一个电子 ④盐酸兼有酸性、氧化性、还原性 ⑤Cl-具有酸性 ⑥Cl2的氧化性比MnO2的强 ⑦Cl2只有氧化性而没有还原性
| A.①②⑤⑥ | B.仅②④⑥ | C.仅②③④ | D.②③④⑥ |
下列离子方程式或化学方程式中正确的有
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2===CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2===2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2===2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-===3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-===Fe(OH)3↓
⑧硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-===Fe2S3
| A.2项 | B.3项 | C.4项 | D.5项 |
水溶液X中只可能溶有Na+、K+、Mg2+、Al3+、AlO2—、SiO32—、HCO3—、CO32—、SO42-中的若干种离子。某同学对该溶液进行了如下实验:
下列判断正确的是
| A.K+、AlO2—和SiO32—一定存在于溶液X中 |
| B.HCO3—和SO42-一定不存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
| D.溶液中一定存在大量CO32— |
下列各物质中,不能够按照 (“→”表示一步完成)关系相互转化的有
(“→”表示一步完成)关系相互转化的有
| 物质 编号 |
a |
b |
c |
| 1 |
Na |
Na2O2 |
NaCl |
| 2 |
NaOH |
NaHCO3 |
Na2CO3 |
| 3 |
Al2O3 |
NaAlO2 |
Al(OH)3 |
| 4 |
AlCl3 |
Al(OH)3 |
NaAlO2 |
| 5 |
FeO |
Fe(NO3)2 |
Fe(OH)2 |
| 6 |
MgCl2 |
Mg(OH)2 |
MgO |
| 7 |
CuO |
CuSO4 |
Cu(OH)2 |
| 8 |
Si |
SiO2 |
H2SiO3 |
| 9 |
C |
CO |
CO2 |
A.1项 B.2项 C.3项 D.4项
某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成。将该粉末
与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定)
有剩余气体。若将原来混合粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量
大于原混合粉末的质量。下列判断正确的是
①粉末中一定有Na2O、Na2O2、NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl
| A.①② | B.②③ | C.③④ | D.①④ |
某同学用以下装置制备并检验Cl2的性质。下列说法正确的是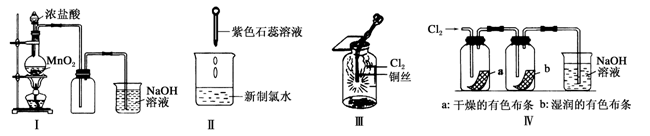
| A.Ⅰ图:若浓盐酸过量,则理论上MnO2可全部消耗完 |
| B.Ⅱ图:证明新制氯水只具有酸性 |
| C.Ⅲ图:产生了棕黄色的雾 |
| D.Ⅳ图:湿润的有色布条褪色,说明氯气具有漂白性 |
在硫酸铁溶液中,加入a g铜完全溶解后再加入b g铁,充分反应后得到c g残余固体,下列说法中正确的有
①若a>c,则残余固体是铁和Cu的混合物
②若a>c,则最终溶液中一定有Fe2+、和Cu2+
③若a>c,则最终溶液中一定没有Fe3+
④若a<c,则最终溶液中可能有Cu2+
⑤若a<c,则最终溶液中一定有Fe2+
| A.0项 | B.1项 | C.2项 | D.3项 |
向一定量Fe、FeO和Fe2O3的混合物中,加入120 mL 4 mol·L 的稀硝酸,恰好使混合物完
的稀硝酸,恰好使混合物完
全溶解,放出1.344 L(标准状况)气体,往所得溶液中加入KMnO4的酸性溶液,无明显现象,
若用足量的H2在加热条件下还原相同质量的混合物,能得到铁的物质的量为
| A.0.21 mol | B.0.14 mol | C.0.16 mol | D.0.24 mol |
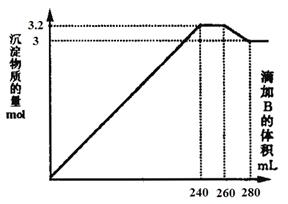
浓度相同的NaOH溶液各100 mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量
的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与
所加盐酸体积之间关系如下图所示。下列判断正确的是
A.通入CO2后,A烧杯中的溶质成分是Na2CO3
B.B烧杯中通入的CO2体积为448 mL
C.原NaOH溶液的浓度为0.2 mol/L
D.通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶2
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
| |
100mL 盐酸 |
100mL 盐酸 |
100mL 盐酸 |
| m(混合物) |
14.2g |
25g |
27.6g |
| V(CO2) |
3.36L |
4.48L |
4.48L |
A.盐酸的物质的量浓度为3.0mol·L
B.加入混合物14.2g时盐酸不足
C.加入25g混合物时盐酸过量
D.根据表中数据计算出混合物中NaHCO3与KHCO3的物质的量之比是
A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。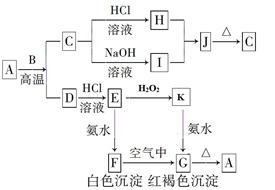
按要求写方程式:
(1)A与B在高温条件下生成C和D的化学方程式:_________________________
(2)F在空气中转化为G的化学方程式:___________________________________
(3)C转化为I的离子方程式:_______________________________________
(4)E转化为K的离子方程式:______________________________________
硅单质及其化合物应用范围很广。制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
(1)第①步制备粗硅的化学方程式为________________________________。
第④步由纯SiHCl3制备高纯硅的化学方程式为___________________________________。
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是________。
②反应一段时间后,装置D中观察到的现象是_______,装置D不能采用普通玻璃管的原因是________。
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________;H2还原SiHCl3过程中若混入O2,可能引起的后果是________;整个制备过程必须严格控制____________。
(3)下列有关硅材料的说法正确的是________(填字母)。
| A.碳化硅硬度大,可用于生产砂纸、砂轮等 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
在一定条件下相互转化关系如图所示(反应条件和部分产物已省略)
(1)若A为金属单质,B、C为常温下气态非金属单质,D为黑色晶体,A和E在一定条件下反应生成D的化学方程式为 .
(2)若A为金属单质,B、C为非金属单质,C为黑色固体,A和E在一定条件下反应生成D的化学方程式为 .
(3)若A为非金属单质,B为金属单质,C为D的水溶液,图示中所有反应均为化合反应,A和E在水溶液中反应生成D的离子方程式为____________________________,B和C在水溶液中反应生成E的离子方程式为_______________________________________。
下图为中学化学实验中的常见实验装置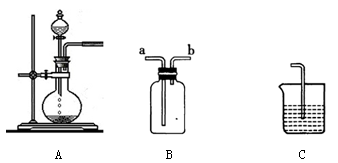
(1)装置A可用于制备多种气体,请写出用A装置制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂
| 气体 |
O2 |
CO2 |
HCl |
| 试剂 |
|
|
|
(2)装置B可用于收集多种气体,若要用于收集Cl2,则进气管为________;若要收集CO,简述用装置B收集CO的方法________________________________
(3)现要用上述装置制取Cl2,并设计实验比较Cl2和I2的氧化性强弱,请在表格内依次填上所需的装置和试剂(可不填满)
| 装置 |
该装置中反应的离子方程式 |
| |
|
| |
|
| |
|
| |
|
 粤公网安备 44130202000953号
粤公网安备 44130202000953号