对某些化学反应,由于反应物用量不同,产物也会有所不同,试根据溶液中离子反应的初步知识,完成下列情况下的离子方程式。
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子反应方程式 ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,写出发生反应的离子方程式 ;
(3)向Ba(OH)2溶液中逐滴加入NaHSO4至恰好完全沉淀,写出反应的离子方程式 ;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,写出发生反应的离子方程式 。
(本题共13分)A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E顺序增大;C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2反应生成C2A和气体物质EB4;EB4蒸气的密度是相同条件下空气密度的3.586倍。
23、指出A在元素周期表中的位置_________。
24、写出D2A2的电子式__________;写出CB与EA2反应的化学方程式___________________。
25、下表是不同物质中的键长和键能的数据,其中a、b、d未知,通过表中的数据分析,估计出a、b、c、d的大小顺序为______________________________。
| 共价键 |
C-C |
C=C |
 C C C C |
C-O |
C=O |
H-F |
N=N |
 N N N N |
| 键长(nm) |
0.154 |
0.134 |
0.120 |
0.143 |
0.122 |
0.092 |
0.120 |
0.110 |
| 键能(kJ/mol) |
a |
b |
|
358 |
c=805 |
569 |
d |
|
氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
26、不能通过电解纯净的液态HF获得F2,其原因是_________;但电解液态KHF2时,两极分别得到F2和H2,则F2在电解池的_____极产生。
27、利用化学反应也能制取氟。请配平下列化学方程式:
____K2MnF6+____SbF5→____KSbF6+____MnF3+____F2↑
28、一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图示。
用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:____________________。
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
请回答:
(1)写出A和C的化学式:A C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
_________________________________、___________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:_____________________________。
(4)写出由F→H的化学方程式:__________________________________________。
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是 。
(2)反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
(3)x、y对应的数值范围分别是 、 。
(4)下列关于NaClO调pH的说法正确的是 。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的
c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的。
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的。
(5)用NaClO调pH,写出氯气制取漂白液的离子方程式: 。
(6分)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余的Cr3+的物质的量浓度为 mol·L-1(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2 S2O3标准溶液,终点时消耗Na2 S2O3溶液20.00 ml。计算废水中铬元素总浓度 mg·L-l
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-
完成下列反应的离子方程式
①磁性氧化铁溶于稀硝酸:
②Ca(HCO3)2溶液中加入少量NaOH溶液:
③明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:
④向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:
⑤氢氧化铁溶于氢碘酸中:
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0 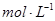 的
的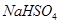 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的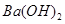 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。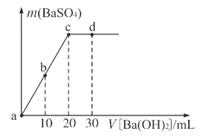
(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
请按指定要求完成下列问题。
⑴向酸性高锰酸钾溶液中通入二氧化硫气体,高锰酸钾被还原为硫酸锰(请书写离子方程式)___________________。
⑵向酸性硫酸亚铁溶液中滴加过量双氧水(请书写离子方程式)_____________________。
⑶向溴化亚铁溶液中通入等物质的量的氯气(请书离子方程式)__________________。
⑷将四氧化三铁溶于过量的稀硝酸(请书写离子方程式)__________________________。
⑸乙醇被硫酸酸化的重铬酸钾溶液氧化成乙酸,重铬酸钾被还原为硫酸铬(请完成化学方程式)_______________。
⑹S + NaOH = Na2Sx + Na2S2O3 + H2O (用含x的代数式配平方程式,并标出电子转移的方向和数目)_________________________________________________________________
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
金属铅为带蓝色的银白色重金属,其单质及化合物可用于铅蓄电池、耐酸设备及X射线防护材料。回答下列问题:
(1)铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-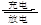 2PbSO4+2H2O。写出放电时负极的电极反应式 。
2PbSO4+2H2O。写出放电时负极的电极反应式 。
(2)早在古代,硫酸铅就被用作白色颜料,但用这种颜料作出的画天长日久会变为黑色,经检测其成分为PbS。古画修复师在变黑处涂抹H2O2后即可将颜色修复,用化学方程式表示古画修复颜色的原理 。
(3)PbO与次氯酸钠溶液反应可以制得PbO2,写出该反应的离子方程式 。
(4)PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x= ,m:n= 。
)的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x= ,m:n= 。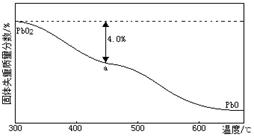
湿法炼锌的冶炼过程可用如图简略表示:

请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.



(9分)盐酸常用于清除金属表面的铜锈铁锈。某同学欲将除锈后的盐酸中的金属元素分步沉淀,查资料获知常温下水溶液中各离子沉淀的pH范围:
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 0 |
3. 0 |
| Fe2+ |
5. 8 |
8. 8 |
| Cu2+ |
4.2 |
6.7 |
(1)若以离子浓度降至1×10-5 mol·L-1为沉淀完全,根据上表数据推算出ksp[Fe(OH)3]=
(2)根据上述数据该同学设计了以下实验流程:
A可能是 ;试剂B的化学式是 ;沉淀②化学式是 。
(15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: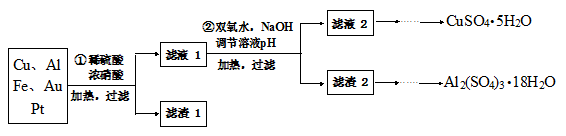
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O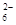 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
II、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。
写出在氨气的出气口处,检验有氨气生成的操作:
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。