(6分)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性强更易被人体吸收且在体内蓄积。工业上处理酸性含Cr2O72-废水的方法如下:
(1)向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
(2)调节溶液的pH,使Cr3+完全沉淀。25℃时,若调节溶液的pH=8,则溶液中残余的Cr3+的物质的量浓度为 mol·L-1(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)。
(3)铬元素总浓度的测定:准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2 S2O3标准溶液,终点时消耗Na2 S2O3溶液20.00 ml。计算废水中铬元素总浓度 mg·L-l
已知测定过程中发生的反应如下:
①2Cr3++3S2O82-+7H2O =Cr2O72-+6SO42-+14H+
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
③I2+2S2O32-=2I-+S4O62-


 Fe(CO)5(g)
Fe(CO)5(g) Fe(CO)5(g)的平衡常数表达式为
Fe(CO)5(g)的平衡常数表达式为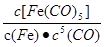
 粤公网安备 44130202000953号
粤公网安备 44130202000953号