(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有____性(填氧化性或还原性)。铁粉也可以将Fe3+转变为易吸收的Fe2+,离子方程式为:_________________。
(2)印刷电路板是高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”溶解铜箔,生成CuCl2和FeCl2相关的化学方程式:________________________。
下图是部分短周期元素的常见化合价与原子序数的关系图:
(1)画出A的原子结构示意简图________________________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,请写出表示A2H6燃烧热的热化学方程式:_______________;
(3)用电子式表示D2G的形成过程__________________;其所含化学键类型为__________________;
(4)C2-、D+、G2-离子半径大小顺序是_____>______>______(用离子符号回答);
(5)C、G元素所形成的氢化物稳定性为_________>________(填化学式),原因是:_________________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系,装置如图.
①溶液a和b分别为_______________,_______________;
②溶液c中发生反应的离子方程式为_________________;
进行污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)~CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
(1)写出双硫腙和Fe3+络合的离子方程式 ,
萃取Fe3+的过程中要控制适宜的酸度,如果溶液的pH过大,其后果是 。
(2)如图是用双硫腙(H2Dz)~CCl4络合萃取某些金属离子的酸度曲线,它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)~CCl4络合萃取法处理废水。
①欲完全将废水中的Hg2+分离出来,须控制溶液的pH= 。
②当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
③萃取到CCl4中的Zn(HDz)2分液后,加入足量NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式:
(3)污水中的亚汞离子(H )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H 生成硫酸汞,写出该反应的化学方程式: 。
生成硫酸汞,写出该反应的化学方程式: 。
【化学——选修2化学与技术】
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 |
| C.将原料粉碎 | D.增加纯碱的用量 |
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式 。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为 。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为 。
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
| A.Na2CO3 | B.KSCN | C.NH4NO3 | D.KOH |
日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:

试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
按要求写出下列方程式:
(1)少量钠投入FeCl3溶液中反应的总离子方程式 ;
(2)过氧化钠投入硫酸铜溶液中总离子方程式 ;
(3)碳酸氢钡与足量氢氧化钠反应的离子化学方程式 ;
(4)醋酸与碳酸氢钠反应的离子方程式_____________________________________________;
(5)氧化钠与足量硫酸溶液反应的离子方程式_______________________________________;
(6)向NaHSO4溶液滴入氢氧化钡溶液至中性,继续向反应后的溶液中滴入氢氧化钡的离子方程式
。
已知实验室制取Cl2的反应为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
MnCl2+Cl2↑+2H2O,又已知Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,也能氧化浓盐酸生成Cl2;
(1)写出PbO2与浓盐酸反应的化学方程式 ,其中表现还原性的HCl与表现酸性的HCl的物质的量之比为
(2)已知硫酸铅不溶于水,铅蓄电池的工作原理为Pb+PbO2 +2H2SO4 =2PbSO4+2H20,写出该反应的离子方程式 ;溶液中硫酸根离子检验的方法为 。
(3)已知PbSO4不溶于水,但可溶于醋酸铵溶液,反应方程式如下:PbSO4 +2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.
①PbSO4与CH3COONH4能进行反应的原因是符合了复分解反应条件之一的生成了 ,现将Na2S 溶液与醋酸铅溶液混合有沉淀生成,则其反应的离子方程式应为 。
②已知+2价Sn的化合物具有强还原性。等物质的量的PbO2和SnO的混合物溶于过量的稀硫酸中,溶液中存在的主要金属阳离子是 (填序号)。
| A.Pb2+ | B.Pb4+ | C.Sn2+ | D.Sn4+ |
某溶液中含有X-、Y2-、Z2-三种常见的无机离子。如下图所示,发生了一系列化学反应。第④步反应生成的白色沉淀中含Y2-.

|
有X、Y、Z、W四种物质的水溶液,它们分别是Na2CO3、NaOH、CH3COOH和NaCl中的一种。已知X、Y两溶液中水的电离程度相同,X、Z两溶液的pH相同,请回答下列问题:
(1)X是 ,Z是 ;
(2)Z、W两溶液中水的电离程度由大到小的顺序为 (用化学式表示);
(3)写出Z溶液与过量Y溶液反应的离子方程式 ;
(4)X、Y两溶液恰好完全反应后,溶液中各离子浓度由大到小的顺序是
。
(1)下列物质:①氯气、②铜片、③碳酸钙、④蔗糖、⑤HCl气体、⑥SO2气体、⑦氨水,能导电的是 ,属于电解质的是 。(填编号)
(2)现有:①铝、②二氧化硅、③二氧化硫、④二氧化碳、⑤三氧化二铁、⑥氢氧化钠、⑦氢氧化镁、⑧氢氧化铝、⑨氢氧化铁,能形成酸雨的是________;光纤制品的基本原料是__________;属于两性氢氧化物的是___________;红棕色固体是_____________。(填编号)
(3)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于 效应。
(4)胃舒平是治疗胃酸(盐酸)过多的常用药物。其中含有的有效成分是氢氧化铝,其治疗原理是(用化学方程式表示): ;碳酸氢钠也常用于治疗胃酸过多,写出反应的离子方程式 。
(12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
(1)已知A为单质,则A为 (填化学式,下同),E为 。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白 色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
某溶液仅含下列离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol 。
阳离子:Na+ 、Mg2+ 、Fe3+ 、Al3+ 、Fe2+ ;阴离子:OH—、CO32—、Cl—、NO3—、SO42—。
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变; 请推断:
(1)原溶液中含有阳离子 含有阴离子
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体
质量为 g。
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S 、HNO3、NO 、H2O;则该反应中还原产物是_____;若反应过程中转移了0.3mol电子,则氧化产物的质量是_____g。
(2)将a mol Cl2通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,写出另2个可能发生的离子方程式。
①当 a / b =1时 ;
②当a / b≥3/2时 。
(3)观察如下反应,总结规律,然后完成下列问题:
①Al(OH)3+H2O  Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
Al(OH)4-+ H+ ;② Cl2+2OH-= Cl-+ ClO-+H2O
(Ⅰ)已知B(OH)3是一元弱酸,试写出其电离方程式: ;
(Ⅱ)单质氰(CN)2是类卤素,试写出其与氢氧化钠溶液反应的离子方程式 。
I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
| A.容量瓶中原有少量蒸馏水 |
| B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中; |
| C.定容时观察液面俯视 |
| D.溶解后未经冷却立即转移至容量瓶内 |
(2)FeCl3可以腐蚀蚀刷电路铜板,反应的离子方程式为________________________________K2FeO4是一种强氧化剂,可作为水处理剂和高容量电池材料。K2FeO4可以由与FeCl3 与KClO在强碱性条件下反应制得,其反应的离子方程式为
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知: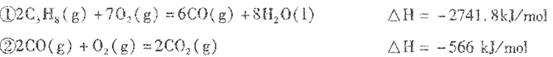
(1)反应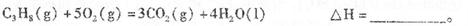
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。