[河南]2012-2013学年河南省西华一高高三上学期第一次月考化学试卷
下图所示为2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
| A.根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 | B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 | D.化学反应中分子的种类发生了改变 |
设N 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
A.4.6 g组成为 的有机物,所含C—H键数目一定为0.6N 的有机物,所含C—H键数目一定为0.6N |
B.8.7 g  与40 mL 10 与40 mL 10  的浓盐酸充分反应,生成的氯气分子数为0.1N 的浓盐酸充分反应,生成的氯气分子数为0.1N |
C.1 mol  中含有的阴、阳离子总数是3N 中含有的阴、阳离子总数是3N 而1 mol 而1 mol 中含有的阴、阳离子总数是4N 中含有的阴、阳离子总数是4N |
D.在反应   ↑ ↑ 中,每生成4 mol 中,每生成4 mol  转移电子数为15N 转移电子数为15N |
在化学学科中经常使用下列物理量,其中跟阿伏加德罗常数(N 无关的组合是
无关的组合是
①相对原子质量 ②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
⑥溶解度(S) ⑦溶质的质量分数(w)
| A.①③⑥⑦ | B.②④⑤⑥ | C.①②③⑤ | D.②③⑤⑥⑦ |
李敏同学欲配制250 mL 1.0 
 溶液,正确的方法是
溶液,正确的方法是
①将35.5 g  固体溶于250 mL水中
固体溶于250 mL水中
②将80.5 g  固体溶于少量水中.再用水稀释至250 mL
固体溶于少量水中.再用水稀释至250 mL
③将50 mL 5.0 
 溶液用水稀释至250 mL
溶液用水稀释至250 mL
| A.①② | B.②③ | C.①③ | D.①②③ |
如限定使用以下物质:正盐(钾盐、钠盐、铵盐、钡盐)、酸(盐酸、硝酸、醋酸、稀硫酸)。那么符合离子方程式: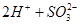 ===
===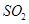 ↑
↑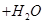 的化学反应式共有
的化学反应式共有
| A.6个 | B.8个 | C.9个 | D.12个 |
用水热法制备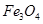 纳米颗粒的总反应如下:
纳米颗粒的总反应如下:
3 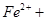
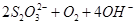 ===
===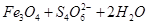 。下列说法正确的是
。下列说法正确的是
| A.在反应中硫元素被氧化,铁元素被还原 | B.还原剂是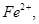 氧化剂是 氧化剂是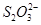 和 和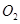 |
C.每生成1 mol 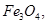 转移3 mol电子 转移3 mol电子 |
D.当转移1 mol电子时,消耗56 g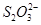 |
下列离子方程式的书写中正确的是
A.碳酸氢钙溶液中加入足量烧碱溶液: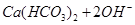 === ===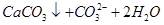 |
B.向溴水中通入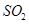 : :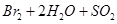 === ===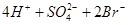 |
C.向氨水中通过量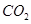 : :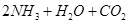 === ===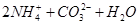 |
D.向次氯酸钙溶液中通入少量的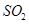 : :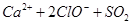 === ===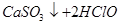 |
某溶液中可能含有 、
、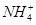 、
、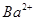 、
、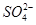 、
、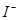 、
、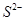 。分别取样:①用pH计测试,溶液显弱酸性;
。分别取样:①用pH计测试,溶液显弱酸性;
②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. |
B.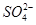 |
C.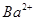 |
D.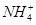 |
水热法制备直径为1 ---100 nm的颗粒Y(化合物),反应原理为: a
a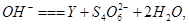 下列说法中不正确的是
下列说法中不正确的是
| A.a=4 | B.将Y均匀分散到水中形成的体系具有丁达尔效应 |
C.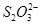 是还原剂 是还原剂 |
D.每有3 mol 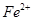 参加反应,反应中转移的电子总数为5 mol 参加反应,反应中转移的电子总数为5 mol |
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲) 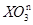 +Xn
+Xn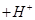 ——X单质
——X单质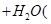 未配平); (乙
未配平); (乙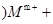 mOH-===M(OH)m
mOH-===M(OH)m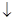
①若n=1,则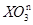 中X元素为+5价,X位于周期表第ⅤA族
中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧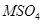 溶液一定能得到
溶液一定能得到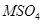
⑤若m=3,则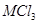 与足量氢氧化钠溶液反应一定生成M(OH)m
与足量氢氧化钠溶液反应一定生成M(OH)m
| A.①③ | B.④⑤ | C.①② | D.②③ |
某溶液中可能存在 、
、 、
、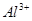 、
、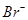 、
、 、
、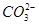 、
、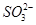 等七种离子中的几种。现取该溶液进行实验,得到如下实验现象: ①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生; ②向所得橙色溶液中加入足量
等七种离子中的几种。现取该溶液进行实验,得到如下实验现象: ①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生; ②向所得橙色溶液中加入足量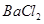 溶液,无沉淀生成; ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
溶液,无沉淀生成; ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断,该溶液中肯定不存在的离子是
A.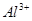 、 、 、 、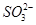 、 、 |
B. 、 、 、 、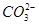 、 、 |
C.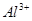 、 、 、 、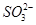 、 、 |
D.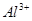 、 、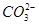 、 、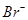 、 、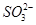 |
已知 + [AI(OH)4]— ===
+ [AI(OH)4]— ===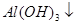
 向含有等物质的量的
向含有等物质的量的 、
、 、
、 的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:
的混合溶液中,慢慢滴加NaOH溶液,直至过量,发生以下离子反应:
①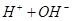 ===
===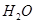 ②
②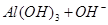 ===[AI(OH)4]—③
===[AI(OH)4]—③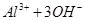 ===
===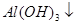
④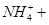
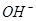 ===
===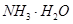 发生反应的先后顺序正确的是
发生反应的先后顺序正确的是
A.①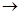 ④ ④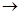 ③ ③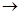 ② ② |
B.①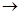 ③ ③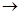 ② ②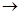 ④ ④ |
C.①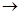 ③ ③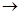 ④ ④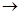 ② ② |
D.①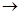 ② ②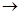 ③ ③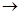 ④ ④ |
在10 mL 0.01 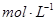 的纯碱溶液中,不断搅拌并逐滴加入2.4 mL 0.05
的纯碱溶液中,不断搅拌并逐滴加入2.4 mL 0.05  的盐酸,完全反应后,在标准状况下生成
的盐酸,完全反应后,在标准状况下生成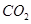 的体积为
的体积为
| A.1.344 mL | B.2.240 mL | C.0.672 mL | D.0.448 mL |
某二价金属的碳酸盐和碳酸氢盐的混合物,跟足量的稀盐酸反应,消耗 和生成的
和生成的 的物质的量之比为5∶4,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为
的物质的量之比为5∶4,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为
| A.1∶1 | B.1∶2 | C.2∶3 | D.1∶3 |
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
| A.A是向Na[AI(OH)4]溶液中滴入HCl至过量 |
B.B是向澄清石灰水中通入 至过量 至过量 |
C.C是向含有盐酸的 溶液中滴入NaOH溶液至过量 溶液中滴入NaOH溶液至过量 |
D.D是向含有等物质的量的 、KOH的混合溶液中通入 、KOH的混合溶液中通入 至沉淀消失 至沉淀消失 |
a g Fe粉与一定量的硝酸在一定条件下充分反应,将生成的气体与标准状况下b L  混合,恰好能被水完全吸收,则a和b的关系可能是
混合,恰好能被水完全吸收,则a和b的关系可能是
| A.b>0.3a | B.b<0.2a | C.0.2 .3a .3a |
D.无法确定 |
(10分))
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,离子反应方程式为 。
(2)常温下,向20 mL 1.0 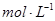 的
的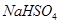 溶液中逐滴加入等物质的量浓度的
溶液中逐滴加入等物质的量浓度的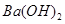 溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。
溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填”酸性”“中性”或”碱性”),b- c之间反应的离子方程式为 。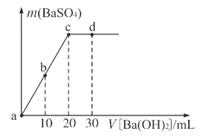
(3)碘酸钾是食盐中的添加剂。检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通SO2的离子方程式为: 。
(10分) 浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器(填字母) |
加入的试剂 |
作 用 |
| |
|
|
| |
|
|
| |
|
|
| |
|
|
| |
|
|
.(12分)由等物质的量的 和
和 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中 与
与 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为  。
。
(3)如果盐酸过量,生成 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道 。
的体积,还需要知道 。
(5)若 和
和 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。
(8分)某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4—恰好完全被还原为Mn2+。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中非金属与金属元素的原子个数比为1:2.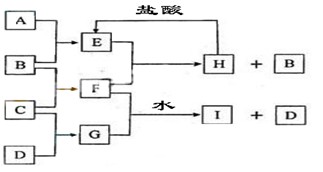
如图所示(图中部分产物末列出):请填写下列空白:
⑴ A是 ,C是————————————
⑵物质F的电子式 , 物质B的结构式
⑶H与盐酸反应生成E的化学方程式是————————————
(4) E与F反应的化学方程式是——————————————————.
.A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有有色气体生成,则C的电子式为 ,反应④的化学方程式为: 。
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ,用电子式表示B分子的形成过程 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 ,分子E的结构式为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号