现有以下物质:①NaOH溶液,②液氨,③BaCO3固体,④熔融KHSO4,⑤Fe(OH)3胶体,⑥铜,⑦CO2,⑧CH3COOH
(1)以上物质中属于混合物的是(填序号)_______,以上物质中属于非电解质的是(填序号)_______。
(2)对物质⑤进行通电,观察到阴阳两极的现象是__________,以上纯净物能导电的是(填序号)_______。
(3)写出①和⑧的水溶液反应的离子方程式_______________________。
(4)写出④的电离方程式______________________。
(5)在足量的④水溶液中加入少量③,发生反应的离子方程式为___________________。
(6)在含0.4mol①的溶液中缓慢通入标准状况下6.72LCO2,气体被全部吸收,则反应后溶液的溶质有___(填化学式),该过程总的离子反应方程式为_______________________。
按要求写出对应的方程式:
(1)H++HCO3-= H2O+CO2↑(写出符合该离子反应的两种不同类型的化学方程式) ; 。
(2)KAl(SO4)2在水溶液中的电离方程式: 。
(3)足量碳酸氢钙和饱和石灰水反应的离子方程式:________________________________。
写出下列反应的离子方程式。
(1)用稀硫酸清洗铁锈(Fe2O3)_____________________________________
(2)碳酸钠溶液与盐酸混合___________________________________________
(3)硫酸铜溶液和氢氧化钡溶液混合_____________________________
(4)向足量澄清石灰水中通入二氧化碳________________________
(8分)小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是: 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①探究Fe2+的还原性,若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,你认为可能观察到的现象是:溶液由浅绿色变为 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选 滴入小明所得的混合液中,并通过溶液出现 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果发现铜片没变化,锌粒逐渐溶解变小。由此说明三种金属的还原性由强至弱的顺序为:____________________________。
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成__________(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成 。
②实际上Fe2+的还原性较强,Fe2+被H2O2氧化成Fe3+,反应的离子方程式为:2Fe2++ H2O2+ 2H+=2Fe3++ 2H2O,请用双线桥标出电子转移情况: 。
将0.1molMg 、Al混合物溶于100mL3mol/LHCl中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V变化如图所示:

(1)写出A→B段反应的离子方程式 。
(2)A点沉淀的总物质的量n= 。
(3)欲使Mg2+ 、Al3+刚好沉淀完全,则加入NaOH溶液的体积V2= mL。
(4)若V1="60mL" ,则混合物中Mg的物质的量n(Mg)= ,V3点所加NaOH溶液的体积为V3=________mL。
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。它们的浓度不同可能会影响它们的某些化学性质。在三种酸中:
(1)常温下能用铁制容器盛装的是 (填名称,下同)。
(2)检验氯离子时使用的是 酸化的硝酸银溶液;高锰酸钾溶液的氧化性与溶液的酸性有关,通常使用 来酸化;能溶解金和铂的是 的混合液。
(3)向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,已知该反应的产物只有氯化铜和水。写出其离子方程式 。
(4)在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体换算成标准状况下的体积可能是 。
①6.72L ②20.16L ③30.24L ④40.32L
(8分)在分开盛放的A、B两种溶液中,共含有Na+、H+、Ag+、Ba2+、NO3—、Cl—、CO32—七种离子,已知A溶液中含有三种阳离子和一种阴离子,则B溶液中所含的离子是 。取少量A溶液,向其中滴入CaCl2至不再有沉淀生成后,过滤,将此滤液逐滴加入到过量的B溶液中,则滤液中发生的离子反应有 , , 。
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右(写出最佳答案)

(1)沉淀1的化学式是 ,试剂C的名称是 ,分离出沉淀2的操作名称是 ;
(2)写出混合液+A的离子方程式
生成沉淀2的离子方程式
(8分)
(1)写出下列反应的离子方程式
①Ca(HCO3)2与过量的NaOH溶液的反应:
②CH3COOH溶液与NaOH溶液反应:
(2)写出下列反应的离子方程式,并在离子方程式中用“单线桥”表示电子转移的方向和数目:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
如果此反应生成了5molCl2,发生氧化反应的HCl的物质的量为 mol。
已知: 2Fe2+ + Br2=2Fe3++2Br-;Cl2+2Br-= Br2+2Cl-
在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应。
(1)当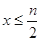 时,反应的离子方程式为_________________________
时,反应的离子方程式为_________________________
(2)当反应的离子方程式为:3Cl2+2Fe2+ +4Br-=2Br2+2Fe3+ +6Cl-时,x与n的关系为_____
(3)当Fe2+和Br-同时被氧化时,x与n的关系是_______________
(4)当x=n时,反应后氧化产物的物质的量为________________
工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+==Cu+Cu2++H2O
| 沉淀物 |
 |
 |
 |
 |
| 开始沉淀pH |
5.4 |
4.0 |
2.2 |
5.8 |
| 沉淀完成pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)固体混合物A中的成分是 (填化学式)。
(2)反应I完成后,铁元素的存在形式为 (填离子符号)。
(3)y的数值范围是 。
(4)若电解法获得Cu 64.0g,则原矿渣中Cu2O的质量是 。
a、144.0g b、大于144.0g c、小于144.0g
(5)下列关于用NaClO调节溶液pH的说法正确的是 。
a、加入NaClO可使溶液的pH降低
b、NaClO能调节pH的主要原因是由于发生反应: 消耗H+,从而达到调节pH的目的
消耗H+,从而达到调节pH的目的
c、NaClO能调节pH的主要原因是由于NaClO水解: OH—消耗H+,从而达到调节pH的目的。
OH—消耗H+,从而达到调节pH的目的。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为 。
①配平:□KMnO4+□HCl→□KCl+□MnCl2+□Cl2+□□;
②0.2mol/LNaHSO4溶液中H+浓度为0.2mol/L,该溶液与0.1mol/LBa(OH)2溶液等体积反应时的离子方程式为 。
(15分:除注明分数的小题之外,其余为1分))
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:
(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_________。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:___ 。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式_________________________________________。
(3)反应②的离子方程式_________________________________________。
(4)F→G的化学方程式___________________________________________。
(12分,每空3分)已知A为金属单质,C为一种强碱。它们有以下相互转化。试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由D转变成H的化学方程式 。
(3)写出向G溶液加入A的有关离子反应方程式 。