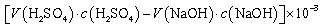已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为 ,将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应原理为 Mg+H2O2+2H+===Mg2++2H2O, 则正极反应式为 。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+浓度为______。当溶液pH=6时, (填“有”或“没有”)Mg(OH)2沉淀析出(已知Ksp[Mg(OH)2]=5.6×10-12)。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为____(提示:I2+2S2O===2I-+S4O)(结果保留一位小数)。
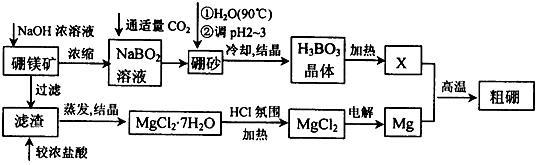
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。

(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
8.1 |
3.8 |
9.5 |
| 完全沉淀pH |
3.7 |
9.6 |
4.8 |
11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。
分高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ + ,完成并配平上述反应的离子方程式。
铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_______________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: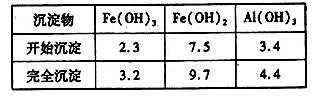
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:

①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:

①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。

(6)氧化—还原法消除NOx的转化如下:

①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被吸收的离子方程式是 。
(1)已知常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(l)=H2O(g)△H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式________________________。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。工业上用如下方法好处甲醇:

①方法一:该反应的△S__ ___0(填“>”或“<”)。图中曲线a到曲线b的措施是____ _____,恒温恒容时,下列说法能说明反应到达平衡状态的是___ _____。
| A.体系的平均摩尔质量不再改变 | B.V(CO)=V(CH3OH) |
| C.H2的转化率达到了最大限度 | D.△H不再改变 |
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:___________;a,b两点化学反应速率别用Va、Vb表示,则Va__ ___Vb(填“大于”、“小于”或“等于”)。已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法二的原子利用率与方法一的原子利用率之比为__ _。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式____ _____。
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
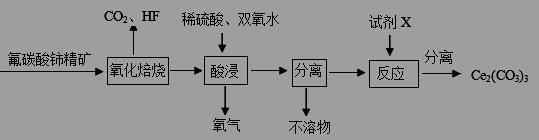
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
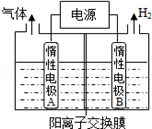
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”).
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为 ,铁渣中铁元素的化合价为 ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为 。
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 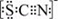 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ |
现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |
(14分)研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义。
(1)二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为____________。
向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是:_________________。
(2)电解法是目前研究最为热门的生产ClO2的方法之一。下图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。
①电源负极为_______极(填A或B):
②写出阴极室发生反应依次为:______________________、______________________;
(3)已知:
2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g)  2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g)  SO3 (g) +NO(g)的△H = kJ·mol-1
SO3 (g) +NO(g)的△H = kJ·mol-1
一定条件下,将体积比为1:2的NO2(g)、 SO2 (g)置于密闭容器中发生上述反应,测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K=______。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应①的化学方程式为__________________,反应④的化学方程式为________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,反应②的离子方程式是_____________________________________.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________。
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题: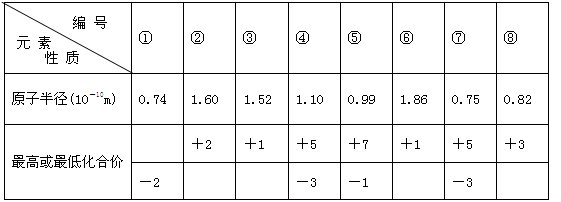
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;名称是 ;碱性最强的化合物是: ;
(3)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4)写出实验室制取⑦的氢化物的化学方程式 。
(5)写出⑦的氢化物与①的常见单质在Pt催化下反应的化学方程式: 。
(6)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式: 。
合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l) ==2 NH3(g)+CO2(g) △H =" +133.6" kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。
结合①中信息,尿素还原NO(g)的热化学方程式是 。
②密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)==CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中离子浓度大小关系是c(Na+)>______。
氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应: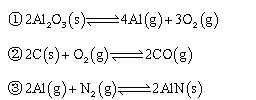
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量:
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: