下表为元素周期表中的一部分,列出10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
⑥ |
|
⑦ |
|
|
| 3 |
① |
③ |
⑤ |
|
⑧ |
|
⑨ |
⑩ |
| 4 |
② |
④ |
|
|
|
|
|
|
(1)10种元素中,化学性质最不活泼的是___________;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是__________;(填化学式)
(3)元素⑦的氢化物(10电子分子)的化学式为___________;该氢化物常温下和元素①的单质反应的化学方程式_____________________________;
(4)元素⑧的最高价氧化物对应水化物的化学式为________;元素⑨的最高正化合价为__________,氢化物的化学式为_____________;
(5)元素①和⑤的最高价氧化物对应的水化物相互反应的离子方程式为________________。
废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(6)相同物质的量浓度的以下三种溶液中,NH4+的浓度由大到小的顺序是 。
a.Fe2(SO4) 3·(NH4) 2SO4·24H2O
b.(NH4) 2SO4
c.(NH4) 2CO3
(14分) Ⅰ.已知向含有淀粉的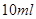
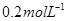
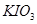 酸性溶液滴加
酸性溶液滴加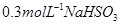 溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
①( )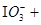 ( )
( )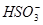 =( )
=( )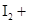 ( )
( )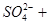 ( )
( )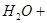 ( )
( )
②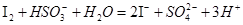
回答下列问题:
(1)写出①反应的离子反应方程式 .
(2)根据①②反应写出还原性粒子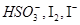 由强到弱的顺序 .
由强到弱的顺序 .
(3)溶液刚好褪色时,则消耗的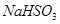 溶液的体积为 .
溶液的体积为 .
(4)预测已知向含有淀粉的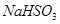 溶液滴加
溶液滴加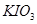 溶液的现象 .
溶液的现象 .
Ⅱ.在密闭容器中,将碳酸氢钠和过氧化钠的混合粉未加热至250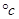 ,使其充分反应最后测得残余固体中两种化合物的组成分别为
,使其充分反应最后测得残余固体中两种化合物的组成分别为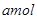 和
和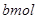 ,且
,且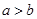 试回答下列问题
试回答下列问题
(1)反应后中固体的成份及其物质的量是: .
(2)原混合物中碳酸氢钠和过氧化钠的物质的量分别为: .
(3)反应后容器气态物质成分及其物质的量是: .
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g)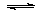 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
(16分)氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式: ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论: ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式: ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7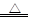 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。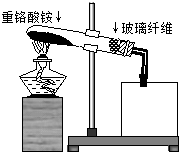
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是 ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂);
③写出该法验证NH3和O2存在的实验原理的化学方程式: 。
(14分)尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
请回答下列问题:
(1)反应①的离子方程式是____________。
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②N2+3H2 2NH3△H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
2NH3△H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
| A.单位时间内生成nmol N2同时消耗3nmol H2 |
| B.混合气体的密度不变 |
| C.混合气体的平均摩尔质量不变 |
| D.N2、H2、NH3浓度之比为1:3:2 |
(4)H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为: 。
(5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3(标准状况)。
(6)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为_____。
现有0.1mol/L的AlCl3溶液和0.1mol/L的氢氧化钠溶液,进行下面的实验。
(1)在试管中取AlCl3溶液10mL,向其中逐滴加入NaOH溶液,请画出产生白色沉淀物质的量随NaOH溶液加入量变化的趋势图。
(2)向盛有10mLNaOH溶液的试管中滴入AlCl3溶液,边滴加边震荡,产生的现象是_ _;当加入 毫升AlCl3溶液时开始出现沉淀;当加入 毫升AlCl3溶液时,产生的沉淀量最多。写出上述过程中所涉及到的的相关离子方程式_ .。
【化学——选修3物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 ,另一种的晶胞如图二所示,该晶胞的空间利用率为 (保留两位有效数字)。(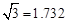 )
)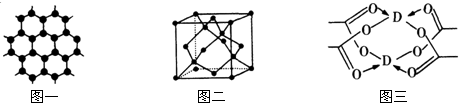
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式 。
雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)写出装置Ⅱ中,酸性条件下反应的离子方程 式 , 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如图所示。①生成Ce4+从电解槽的 (填字母序号)口流出。②写出阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
辉铜矿是冶炼铜的重要原料.
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2===2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜: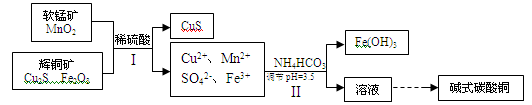
①步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有 (任写一种).
②步骤Ⅱ中调节浸出液pH=3.5的作用是 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
ii)Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 .
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明 (填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(1)下图是部分短周期元素原子半径与原子序数的关系图。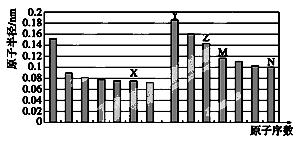
①由X、Y形成的既含离子键又含共价键的物质的电子式:
②实验室制备N单质的离子反应方程式:
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.8×10-5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)羟胺(NH2OH) 可看成是氨分子内的l 个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。NH2OH 的水溶液呈弱碱性的原理与NH3的水溶液相似,用电离方程式表示NH2OH 在水溶液中显碱性的原因 。
(4)“甲醇-空气”绿色燃料电池的工作原理示意图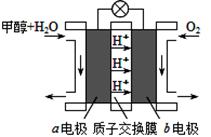
写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计)。
(Ⅰ)硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
①BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+ 571.2 kJ・mol—1
②BaS(s)=Ba(s)+S(s) △H=+460 kJ・mol—1
已知:③2C(s)+O2(g)=2CO(g) △H=" -221" kJ・mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(Ⅱ)污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
则:
①△H3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,阴极反应式为: 。
(本题共12分)石油脱硫废气中含有较多的硫化氢,如何对其进行综合利用回收硫是研究的热点。完成下列填空:
35.实验室用启普发生器制备硫化氢气体,原料可选用__________(选填编号)。
| A.稀盐酸与硫化铜 | B.稀硫酸与硫化亚铁 |
| C.稀硝酸与硫化锌 | D.浓盐酸与硫化钠 |
若要得到一瓶干燥纯净的硫化氢,除启普发生器外,还应选用的装置依次是____(填编号)。
36.如图,将充满相同体积(同温同压)的二氧化硫与硫化氢气体的集气瓶对口放置,抽去毛玻璃片充分反应。观察到的现象是_______________________。检验最终剩余气体的方法是______________。
37.一种回收硫的方法称为克劳斯法,其主要流程是先将部分H2S氧化为SO2,再与剩余H2S作用。若废气中含67.2 m3 H2S,为充分回收硫,需要消耗空气_____m3(设空气中O2的体积分数为0.20)。
38.工业上常用吸收-电解法回收硫。主要过程分两步:
第一步,用FeCl3溶液吸收H2S。此过程中溶液pH_____(填“增大”、“减小”或“不变”)。
第二步,过滤后对滤液进行电解,发生反应的离子方程式为:2Fe2++ 2H+  2Fe3+ + H2↑吸收-电解法的优势是:① H2S的吸收率高;②____________。有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为__________________________。
2Fe3+ + H2↑吸收-电解法的优势是:① H2S的吸收率高;②____________。有人提出,第二步可以改为向所得溶液中通入O2,也能实现同样的目的,此时发生反应的化学方程式为__________________________。
39.请再设计一种从硫化氢中回收硫的方法(用化学方程式表示)。_________________