黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
相关知识点
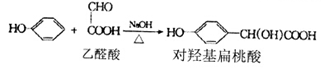
 —氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH
—氢的醛与强碱共热时,该醛一分子被氧化成酸,另一分子被还原成醇的反应称为康尼查罗(Cnanizzoar)反应。如:2HCHO+NaOH  CH3OH+HCOONa
CH3OH+HCOONa ,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。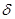 键
键 键
键 )。
)。

 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号