NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式: 。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
| 编号 |
0.02mol/LNaHSO3溶液/mL |
0.02mol/LKIO3溶液/mL |
H2O/mL |
反应温度/℃ |
溶液变蓝的时间t/s |
| ① |
10 |
15 |
a |
10 |
t1 |
| ② |
10 |
40 |
0 |
10 |
t2 |
| ③ |
10 |
b |
0 |
20 |
t3 |
表中a= ,b= 。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应
速率 mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系: 。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二: ;
………………
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)。
| 实验方案(不要求写出具体操作过程) |
预期实验现象和结论 |
| |
|
向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答:
(1)AB段所表示的反应的离子方程式是 ;
CD段所表示的反应的离子方程式是 。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是 。
(3)a是______________,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)= _____________________
_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
试通过计算确定400℃剩余固体成分的化学式 。(写出计算过程)
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是 。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。
所选试剂是____________,该反应的离子方程式为: 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,最佳途径是__________(填序号),理由是 。
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: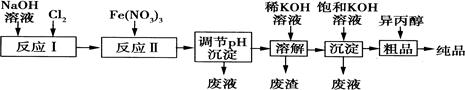
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式) 。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式) 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式) 。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) 。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是 。
a.7:5 b.3:1 c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为 。
物质结构选修模块题
(1)已知:常压下,氨气在300℃时约有9.7%分解,水蒸气在2000℃时约有4%分解,氟化氢气体在3000℃时仍不分解。这三种分子的中心原子与氢原子形成的σ键能由大到小的顺序是 ;其中水分子里的氧原子轨道的杂化类型是 。将过量氨气通入0.1 mol·L―1的蓝色硫酸铜溶液中逐渐形成深蓝色溶液,其离子方程式为: 。
(2)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。下图是金属钛的面心立方结构晶胞示意图,则钛晶体的1个晶胞中钛原子数为 ,钛原子的配位数为 。
(3)晶体硅、锗是良好的半导体材料。磷化铝、砷化镓也是重要的半导体材料,从物质结构的角度分析它们与晶体硅的关系为 。试以原子实的形式写出31号半导体元素镓的电子排布式 。镓与砷相比较,第一电离能更大的是 (用元素符号表示)。
下图是部分短周期元素的常见化合价与原子序数的关系图:
(1)画出A的原子结构示意简图________________________;
(2)A的某氢化物分子式为A2H6,将含630mol电子的A2H6在氧气中完全燃烧生成稳定氧化物放出的热量为QkJ,请写出表示A2H6燃烧热的热化学方程式:_______________;
(3)用电子式表示D2G的形成过程__________________;其所含化学键类型为__________________;
(4)C2-、D+、G2-离子半径大小顺序是_____>______>______(用离子符号回答);
(5)C、G元素所形成的氢化物稳定性为_________>________(填化学式),原因是:_________________;
(6)某同学设计实验证明A、B、F的非金属性强弱关系,装置如图.
①溶液a和b分别为_______________,_______________;
②溶液c中发生反应的离子方程式为_________________;
【化学——选修2化学与技术】
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 |
| C.将原料粉碎 | D.增加纯碱的用量 |
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式 。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为 。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为 。
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
| A.Na2CO3 | B.KSCN | C.NH4NO3 | D.KOH |
(12分)根据下图所示的关系,确定A、B、C、D、E、F的化学式,并写有关方程式。
(1)已知A为单质,则A为 (填化学式,下同),E为 。
(2)D→E的化学方程式为___________________________________。
(3)取少量C溶于水,加入酸化的硝酸银溶液,有白 色沉淀生成,则A→C的化学方程式为_____________________________。
(4)某学习小组设计如下装置进行相关实验:
①打开活塞b,向溶液B中逐滴加入少量溴水,关闭活塞b;
②打开活塞a,向容器中滴入足量的亚硫酸。
按要求回答下列问题:
①滴入溴水时,溶液的颜色变为棕黄色,该反应的离子方程式为________。
②滴入亚硫酸时,溶液由棕黄色变为浅绿色,该反应的离子方程式为______。
③由此可知,B中的阳离子、Br-、H2SO3还原性由强到弱的顺序是___________(B中的阳离子用离子符号表示)。
(共10分)中学化学中几种常见物质的转化关系如下图所示:
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F微粒直径大小的范围:__________。
(2)A、B、H的化学式:A________、B________、H________。
(3)①写出C的酸性溶液与双氧水反应的离子方程式:________________________。
②写出鉴定C中阳离子的实验方法和现象:_______________________。
③在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:_______________________________________________。
已知:A、B、C、D、E、F在常温下均为气体,它们有以下转化关系(部分反应条件、产物已略去)。
请回答下列问题:
(1)将A点燃后伸入到装有E的集气瓶中,可观察到的现象是_________________.
(2)C的浓溶液与黑色粉末反应生成E的化学方程式为________________________。
(3)若将溶液Ⅱ滴入到碘化钾溶液中,发生反应的离子方程式为__________________,向反应后的溶液中加入适量CCl4,充分振荡后静置,可以观察到的现象是_______________。 (4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
(4)与溶液Ⅰ比较,溶液Ⅱ中多出的物质是 (填化学式)。
A、B、C、D为单质,其余物质为化合物。A为银白色金属,D为黑色固体非金属,X在常温下是无色液体,B、C、J在常温下为气体。分别用铂丝蘸取少许E、F、H、I溶液,在无色火焰上灼烧,火焰呈黄色。将J通入澄清石灰水,石灰水先变浑浊,继续通J一段时间,石灰水又变澄清。物质间有如下图转化关系。(图中省略部分反应物和生成物)
(1)请写出下列物质的化学式:
A: B: X: J:
(2)写出下列变化中的化学反应方程式,是离子反应的,写离子反应方程式。
①A→F ;
②X+F→B+I
(3)F在生产和生活中具有重要作用,写出F的一种用途 。
(4)如果I溶液中混有H,要除去H应加适量___ 溶液(填化学式),离子方程式为 。
(原创)(1)除去碳酸钠固体中少量碳酸氢钠的方法是 ,化学方程式为 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3 + ClO-+ OH-=== FeO42-+ Cl-+ ( )
(3)某溶液中可能大量含有Mg2+、Cu2+、Al3+、Cl-、OH-、CO32-。当加入氢氧化钠溶液时,生成白色沉淀的
物质的量与加入氢氧化钠的物质的量关系如图所示。
则溶液中大量含有的离子有______________________,各离子的物质的量浓度之比为____ (与前面的离子顺序相对应)。