某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则加入的检验试剂依次分别是 (写化学式);写出最后检验出的离子与所加试剂反应的离子方程式 。
下列离子方程式正确的是
| A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2===NO3-+NO↑+H2O |
| B.碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O |
| C.用浓盐酸酸化的KMnO4溶液与H2O2反应:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O |
| D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO42-+Ba2++OH-===BaSO4↓+H2O |
下列离子方程式中,正确的是
A.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH-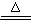 NH3↑+ H2O NH3↑+ H2O |
| B.氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O |
| C.向BA(OH)2溶液中滴加NAHSO4溶液至恰好为中性:BA2+ + OH- + H+ + SO42- = BASO4↓+ H2O |
| D.石灰石与盐酸反应:CACO3+2H+=CA2++CO2↑+H2O |
Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式) 。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式) 。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式) 。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式) 。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是 。
a.7:5 b.3:1 c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为 。
下列解释事实的化学方程式或离子方程式不正确的是( )
| A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 |
| C.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 |
| D.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
下列指定反应的离子方程式正确的是
| A.用白醋除铁锈:Fe2O3·xH2O + 6H+= (3+x)H2O + 2Fe3+ |
| B.用强碱溶液吸收工业制取硝酸尾气: NO + NO2 + 2OH-= 2NO3- + H2O |
| C.将少量SO2气体通入氨水中:SO2 + NH3·H2O=NH4++ HSO3- |
| D.向稀硫酸中加入少量Ba(OH)2溶液:2H++ SO42-+ Ba2++ 2OH-= BaSO4↓ + 2H2O |
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:

(1)反应生成ClO2气体需要X酸酸化,X酸可以为 。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为 。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。写出pH≤2时ClO2与S2-反应的离子方程式_______ 。

(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式_____ _______;处理100 m3这种污水,至少需要ClO2 _____________ mol。
近期发现, 是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
| A. | 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B. | 氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C. | 的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D. | 氢硫酸的还原性强于亚硫酸 |
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H 2所需能量较少的是________.
(3) 与 在高温下发反应:生 .在610k时,将 与 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
① 的平衡转化率 =________%,反应平衡常数K=________.
②在620K重复试验,平衡后水的物质的量分数为0.03, 的转化率 ________ , 该反应的△H________0.(填">""<"或"=")
③向反应器中再分别充入下列气体,能使 转化率增大的是________(填标号)
| A. |
|
B. |
|
C. |
COS |
D. |
|
下列离子方程式与所述事实相符且正确的是( )
A.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++2Cl﹣+Cl2↑+2H2O Mn2++2Cl﹣+Cl2↑+2H2O |
| B.Ca(HCO3)2溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
| D.向次氯酸钠溶液中通入SO2:2ClO−+SO2+H2O=SO32-+2HClO |
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是___________ ,步骤③的实验操作是___________。
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是 _______ 。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是 ___ 。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式 _____________。
(5)已知:2Fe3++2I-→2Fe2++I2 氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:__________。
现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。
(3)除去③中少量②的操作是 ,化学方程式为 。
(4)标准状况下,___________L ④中含有0.4mol 氧原子。
(5)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 。
(6)若在⑦中缓慢加入⑥,产生的现象是 。
(7)将①加入到⑧中,⑧的导电能力变化为__________(填“增强”、“减弱”或“基本不变”)。
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ=Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ=Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+=BaSO4↓ |
| D |
Na+、K+、ClOˉ、SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。
能正确表示下列反应的离子方程式是( )
A.用石墨作电极电解氯化镁溶液:2H2O+2Cl- H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
B.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO2 2NH4++SO32-+H2O 2NH4++SO32-+H2O |
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: |
2Ba2++3OH-+Al3++2SO42- 2BaSO4↓+Al(OH)3↓
2BaSO4↓+Al(OH)3↓