(14分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为_____。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为____________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4─空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________;负极的电极反应式为 。
(12分)某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。


(1)将上述反应设计成原电池如图甲所示,请回答下列问题:
①图中X溶液的溶质是____(填化学式),Cu电极上发生的电极反应方程式为 。
②原电池工作时,盐桥中的_____________ (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量关系如图丙,请回答下列问题:
①M是直流电源的__________极;图丙中的②线是_________的物质的量的变化。
②当电子转移为2mol时,向乙烧杯中加入________ L5mol·L-1NaOH溶液,才能使溶液中所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为___________________________________。
下列表示对应化学反应的离子方程式正确的是
| A.向FeCl3溶液中加入Mg(OH)2: 3Mg(OH)2+2Fe3+ ="=" 2Fe(OH)3 +3 Mg2+ |
B.草酸使酸性KMnO4溶液褪色: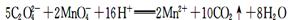 |
C.往NaHS04溶液中滴加Ba(OH)2至溶液呈中性: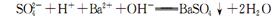 |
| D.向NaCl0溶液中通人少量的CO2:CO2 +2C1O-+H2O ="=" CO32-+ 2 HC1O已知Ka1(H2 CO3)>Ka( HC1O)>Ka2(H2 CO3) |
下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2= 4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
某强酸性溶液X中可能含有H+、A13+、NH4+、Fe2+、CO32-、SO42-、C1-、NO3- 中的若干种。某研究性小组为了探究其成分,进行了如下实验:
请回答下列问题:
(1)沉淀C的化学式为 ,气体A的化学式为 。
(2)写出向溶液H中通入过量CO2气体生成沉淀I的离子方程式: 。
(3)通常可以利用KClO在KOH溶液中氧化沉淀G来制备一种新型、高效、多功能水处理剂K2MO4。(M为G中的一种元素,K2MO4易溶于水)请写出制备过程中的离子方程式(M用具体的元素符号表示) 。
(4)无法确定的离子是 ,请设计实验验证该离子是否存在的方法 。
下列表示对应化学反应的离子方程式正确的是
| A.Na2O2溶于水产生O2:Na2O2+H2O= 2Na++2OH-+O2↑ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+ =Fe3++3H2O |
| C.向FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl- |
| D.向50 mL 1 mol·L-1明矾溶液中滴入两滴0.1 mol·L-1Ba(OH)2溶液: |
2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
下列反应的离子方程式中正确的是
| A.向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O |
| B.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| C.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++ NO↑+ 2H2O |
| D.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+ |
近期发现, 是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
| A. | 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B. | 氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C. | 的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D. | 氢硫酸的还原性强于亚硫酸 |
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H 2所需能量较少的是________.
(3) 与 在高温下发反应:生 .在610k时,将 与 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
① 的平衡转化率 =________%,反应平衡常数K=________.
②在620K重复试验,平衡后水的物质的量分数为0.03, 的转化率 ________ , 该反应的△H________0.(填">""<"或"=")
③向反应器中再分别充入下列气体,能使 转化率增大的是________(填标号)
| A. |
|
B. |
|
C. |
COS |
D. |
|
下列离子方程式与所述事实相符且正确的是( )
A.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) Mn2++2Cl﹣+Cl2↑+2H2O Mn2++2Cl﹣+Cl2↑+2H2O |
| B.Ca(HCO3)2溶液中加入少量烧碱溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
| D.向次氯酸钠溶液中通入SO2:2ClO−+SO2+H2O=SO32-+2HClO |
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①所需要的硅酸盐仪器是___________ ,步骤③的实验操作是___________。
(2)步骤⑤中,某学生选择用苯来提取碘水中的单质碘的理由是 _______ 。(选填序号)
a.单质碘与苯不发生化学反应 b.碘在苯中溶解度小
c.碘在苯中溶解度大 d.苯与水互不相溶
(3)提取碘的过程中,不能使用的有机溶剂是 ___ 。(选填序号)
a.酒精 b.汽油 c.四氯化碳
(4)步骤④中所发生的离子反应方程式 _____________。
(5)已知:2Fe3++2I-→2Fe2++I2 氯气既可以氧化Fe2+,也可以氧化I-。 往FeI2溶液中通入一定量的 Cl2,反应完成后,溶液中有1/2Fe2+被氧化,请写出该反应的化学反应方程式:__________。
现有下列十种物质:①液态氯化氢②小苏打 ③固体纯碱 ④二氧化碳⑤葡萄糖 ⑥氢氧化钾 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩硫酸铁溶液
(1)上述十种物质中,属于电解质的有 ,属于非电解质的有 。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H++OH-=H2O,该反应的化学方程式为 。
(3)除去③中少量②的操作是 ,化学方程式为 。
(4)标准状况下,___________L ④中含有0.4mol 氧原子。
(5)现有100 mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 。
(6)若在⑦中缓慢加入⑥,产生的现象是 。
(7)将①加入到⑧中,⑧的导电能力变化为__________(填“增强”、“减弱”或“基本不变”)。
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ=Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ=Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+=BaSO4↓ |
| D |
Na+、K+、ClOˉ、SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
I. 书写下列反应的化学方程式
(1) 用FeCl3溶液作为腐蚀液刻制铜印刷电路板 ;
(2) 工业上粗硅的制取:
II. 与量有关的离子方程式书写
(1) Ba(OH)2溶液与NaHSO4溶液反应后溶液呈中性:
离子方程式 ;
(2) Ca(HCO3)2溶液与少量NaOH溶液反应
离子方程式 ;
(3) Al2(SO4)3溶液与过量NaOH溶液反应
离子方程式 ;
(学法题)书写此类离子方程式的关键是: 。
能正确表示下列反应的离子方程式是( )
A.用石墨作电极电解氯化镁溶液:2H2O+2Cl- H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
B.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO2 2NH4++SO32-+H2O 2NH4++SO32-+H2O |
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- 3Fe3++NO↑+3H2O 3Fe3++NO↑+3H2O |
| D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: |
2Ba2++3OH-+Al3++2SO42- 2BaSO4↓+Al(OH)3↓
2BaSO4↓+Al(OH)3↓