下列离子方程式中正确的是( )
A.铜与热的浓硫酸:Cu+4H++SO42 Cu2++SO2↑+2H2O Cu2++SO2↑+2H2O |
| B.在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH= NH3·H2O |
| C.用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3 |
| D.氯化亚铁溶液中加入硝酸:2Fe2++4H++NO3-=2Fe3++2H2O+NO↑ |
下列离子方程式表达正确的是
| A.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| B.向Fe(OH)2中加入足量的稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
| C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3·H2O |
| D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进 行下列实验,现象记录如下。
行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出P在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是:_ 。
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
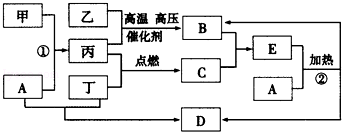
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
下列离子方程式不正确的是
| A.碳酸氢钠溶液与足量石灰水反应:HCO3- + Ca2+ + OH-=CaCO3↓ + H2O |
| B.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
C.电解CuSO4溶液:2Cu2+ + 2H2O 2Cu + O2↑+ 4H+ 2Cu + O2↑+ 4H+ |
D.亚硝酸钠水溶液显碱性:NO2-+H2O HNO2+OH- HNO2+OH- |
下列离子方程式的书写正确的是( )
| A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑ |
| B.NaHCO3溶液与NaOH溶液反应: OH― + HCO3―= CO32― + H2O |
| C.钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
| D.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O |
如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
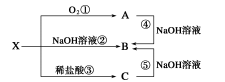
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
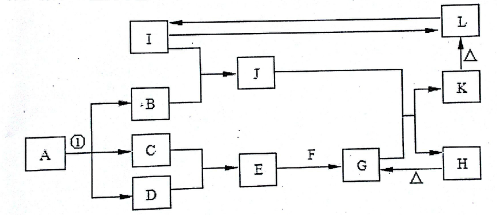
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O 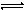 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O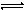 Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O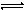 Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O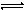 Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
下列离子方程式正确的是
| A.铁粉撒入稀硫酸中2Fe + 6H+ →2Fe3+ + 3H2↑ |
| B.向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O→AlO2-+4NH4++2H2O |
| C.把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ |
| D.用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |
下列离子方程式正确的是
| A.氧化镁与稀硝酸反应:O2-+2H+=H2O |
| B.向稀硫酸溶液中撒入铁粉 2Fe +6H+ = 2Fe3+ +3H2 ↑ |
| C.向碳酸钙中加入盐酸 CO32-+ 2H+ = H2O +CO2 ↑ |
| D.向氢氧化钠溶液中通入少量二氧化碳 2OH-+ CO2 = CO32-+H2O |