下列离子方程式不正确的是
| A.碳酸氢钠溶液与足量石灰水反应:HCO3- + Ca2+ + OH-=CaCO3↓ + H2O |
| B.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
C.电解CuSO4溶液:2Cu2+ + 2H2O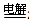 2Cu + O2↑+ 4H+ 2Cu + O2↑+ 4H+ |
D.亚硝酸钠水溶液显碱性:NO2-+H2O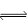 HNO2+OH- HNO2+OH- |
下列离子方程式不正确的是
| A.碳酸氢钠溶液与足量石灰水反应:HCO3- + Ca2+ + OH-=CaCO3↓ + H2O |
| B.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑ |
C.电解CuSO4溶液:2Cu2+ + 2H2O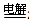 2Cu + O2↑+ 4H+ 2Cu + O2↑+ 4H+ |
D.亚硝酸钠水溶液显碱性:NO2-+H2O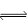 HNO2+OH- HNO2+OH- |