在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:

(1)“O”点导电能力为0的理由是_________________________。
(2)用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________ ;
②醋酸的电离度:_________ ;
③醋酸的电离平衡常数:__________ ;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
(4)若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是 。
| A.c(H+) | B.H+个数 | C.CH3COOH个数 | D.c(H+)/c(CH3COOH) |
下列物质按1﹕1反应的离子方程式正确的是
| A.二氧化碳与石灰水: CO2 + OH- = HCO3- |
| B.氯化铁和硫氢化钠: 2Fe3++2HS- =Fe2++ 2H++ FeS↓+S↓ |
| C.硫酸亚铁铵和氢氧化钡: 2NH4++2OH-+Ba2++SO42-= 2NH3•H2O+BaSO4↓ |
| D.在酸性条件下亚硫酸钠和硫化钠: 2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
下列离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]- + 4NH4+ |
| B.澄清石灰水与过量苏打溶液反应:Ca2+ + HCO3-+ OH-=CaCO3↓+ H2O |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+=Ca2+ +CO2↑+ H2O |
| D.碘化亚铁中通入氯气:2I-+ Cl2=I2+ 2Cl- |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
| A.a点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| B.b点消耗Ba(OH)2溶液体积为200mL |
| C.从a→b 、b→c点过程中发生反应的离子方程式依次为:NH4++OH-=NH3·H2O Al(OH)3+OH-=AlO2-+2H2O |
| D.沉淀的质量:a点>c点 |
下列离子方程式正确的是
| A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++ 2I-= 2Fe2++ I2 |
| B.氧化铝溶解在NaOH溶液中:3H2O + Al2O3 + 2OH-=2[Al(OH)4]- |
| C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全 Al3+ + SO42-+ Ba2+ +3OH-= BaSO4 ↓ + Al(OH)3↓ |
| D.在漂白粉配制成的溶液中通入SO2:Ca2+ + 2ClO-+ SO2 + H2O = CaSO3↓+ 2HClO |
下列离子方程式书写正确的是 ( )
A.实验室制取氯气: MnO2 + 4HCl(浓) Mn2++2 Cl- + Cl2↑+ 2H2O Mn2++2 Cl- + Cl2↑+ 2H2O |
| B.过量的氨水滴加到氯化铝溶液: Al3+ + 4OH-="==" AlO2- + 2H2O |
| C.氯气与水反应: Cl2+H2O===Cl-+2H+ +ClO- |
| D.硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O ="==" H2SiO3↓+2HCO3- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2=2Fe3++2Cl- |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D.铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ |
钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
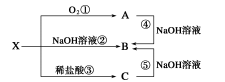
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
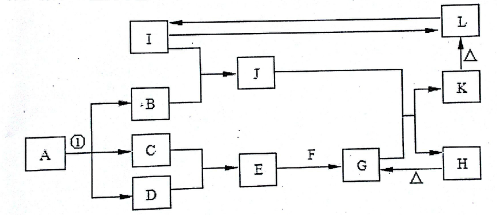
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
下列离子方程式正确的是
| A.铁粉撒入稀硫酸中2Fe + 6H+ →2Fe3+ + 3H2↑ |
| B.向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O→AlO2-+4NH4++2H2O |
| C.把金属钠放入冷水中:Na+H2O→Na++OH-+H2↑ |
| D.用氢氧化钠溶液除去铝表面的氧化铝:Al2O3+2OH-→2AlO2-+H2O |