原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)用电子式表示X与W组成的化合物的形成过程 。
(2)由X和Z组成的某化合物,常用于杀菌消毒,则该化合物的结构式为 。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液不能与铜反应、浓溶液能与铜反应,该反应的化学方程式为 。
(4)由X、Y、Z、W四种元素构成化合物A 。
①已知l mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体。写出加热条件下A与NaOH溶液反应的离子方程式 。
②又知A既能与盐酸反应,又能与氯气反应,写出A与氯水反应的离子方程式: 。
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水,对化合物物B进行如下实验:
取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解则B的化学式为 。
(1)在下面元素周期表中全部是金属元素的区域为 。
(a)A (b)B (c)C (d)D
(2)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍;Y元素单质为双原子分子,其氢化物水溶液呈碱性;1mol单质Z跟盐酸完全反应,能置换出22.4L的H2(标准状况);W元素原子核外M层电子数目比K层多1个;
①请写出元素X的一种核素的化学符号 ;
②写出元素Y在周期表中的位置 ;
③Z、W两元素相比较,金属性较强的元素是 (填元素符号),可以验证该结论的实验是 。
(a)比较两种元素单质的熔点
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)比较这两种元素的最高价氧化物对应水化物的碱性
(d)比较这两种元素的气态氢化物的稳定性
(共14分)某研究性学习小组设计了一组实验,验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯里分别加入50 mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性_____________________;
②反应最剧烈的烧杯里金属是_______(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式 。
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法 。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
(2)乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强。他设计了下图装置以验证碳、氮、硅元素的非金属性强弱。乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成。
①写出所选用物质的化学式:A、 ; C、 。
②写出烧瓶中发生反应的化学方程式: 。
③碳、氮、硅三种元素的非金属性由强到弱顺序为 。
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是 ,写出实验室制备单质F的离子方程式 。
(2)化学组成为BDF2的电子式为: ,A、C、F三种元素形成的化合物CA4F为 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是 (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
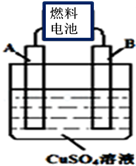
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为 ;每消耗3.4g CA3转移的电子数目为 。
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是 ,溶液中的H+向 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是 。
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断。
(1)该微粒是中性微粒,这种微粒的元素符号是____________;
(2)该微粒的符号为X3-,则这种微粒的单质的电子式为___________;
(3)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式___________________________________;
(4)该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的离子方程式:________________________________;
(5)该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式:__________;
(6)该微粒的符号为X3+,其氢氧化物与强碱反应的离子方程式:______________________.
A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
| 元素符号 |
元素性质或原子结构 |
| A |
A是形成化合物最多的元素 |
| B |
B元素的单质在空气中含量最多 |
| C |
C元素在地壳中含量最多 |
| D |
D元素在同周期中金属性最强 |
| E |
常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置 ;
(2)B的最简单气态氢化物分子空间构型 ;其沸点高于同主族的其它气态氢化物原因 ;
(3)D的最高价氧化物对应水化物的化学键类型 ;
(4)B、C、D、E简单离子半径大小 (用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式 ,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式 .
下表是元素周期表的短周期部分,表中字母分别表示一种元素。

请回答下列问题:
(1)g与b可形成离子化合物b2g2,该物质含有的化学键类型有________ 。
(2)e、f、g三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)________。
(3)从化合物c2g3与eg2组成的混合物中分离提纯eg2,可加入上述________(用元素符号表示)两种元素形成化合物的水溶液后再过滤洗涤。
(4)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志。X可与H2O在一定条件下反应生成化合物A,该反应的化学方程式为:________________________。
(5)航天技术中常使用a和g单质组成的燃料电池,该电池具有高能、轻便和不污染环境等优点。该电池反应为____________________。
K, Fe, C, N, O, S是中学化学常见的六种元素。
(1)K位于元素周期表的第 周期第 族;N的基态原子核外有 个未成对电子。基态Fe2+的核外电子排布式是
(2)用“>”或“<”填空:
(3)在250C、l01kPa下,已知CO与NO在一定条件下反应生成N2和CO2,恢复至原状态,平均每转移lmol电子放热153.9kJ,该反应的热化学方程式是
(4)钢铁在有电解质溶液存在的条件下易发生电化学腐蚀。某同学利用钢铁的电化学腐蚀原理,设计如图甲所示实验:
①写出石墨电极的电极反应式:
②将该装置作筒单修改即可成为铁的电化学防护装置,请在图乙中的虚线框内所示位置作出修改。
锌是一种常用金属,冶炼方法有火法和湿法。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
(1)Ga的原子结构示意图为____________________。
(2)GaN可由Ga和NH3在高温条件下合成,该反应的化学方程式为______________
(3)下列有关镓和镓的化合物的说法正确的是____________________(填字母序号)。
| A.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| B.常温下,Ga可与水剧烈反应放出氢气 |
| C.Ga2O3可由Ga(OH)3受热分解得到 |
| D.一定条件下,Ga2O3可与NaOH反应生成盐 |
II.工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示,回答下列问题:
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,写出ZnFe2O4与H2SO4反应的化学方程式_______________________。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_____________________________________________________。
(6)净化II中加入Zn的目的是______________________________________________。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_______________________。已知:Ksp[Fe(OH)3] =" 8.0" × 10-38;lg5 = 0.7
某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ② 向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③ 将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④ 将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤ 将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥ 向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀。 |
(1)请将各实验步骤对应的实验现象填写入下表中:
| 实验步骤 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
|
|
|
C |
D |
|
(2)此实验可得出的结论是:
Na、Mg、Al金属性强弱关系: ,Cl、S非金属性强弱关系: 。
门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因____________。冶炼金属镓通常采用的方法是____________。
②为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、____和____。
X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。请回答下列问题:
(1)X元素的名称是______________
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)_________________
(3)写出F的电子式_____________________
(4)B中含有的化学键是 (填“离子键或极性键或非极性键”);请举一例说明B的用途______________
(5)请写出由化合物C制取Y的单质反应的化学方程式____________________
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同一主族元素,A元素的一种核素无中子,F元素的最外层电子数是次外层电子数的0.75倍,B元素的的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。
请回答:
(1)A、D、F形成化合物的电子式为_______。
(2)工业上在高温的条件下,可以用A2C和BC反应制取单质A2。在2L密闭容器中分别充入1 mol A2C和1 mol BC,一定条件下,2 min达平衡时生成0.4 mol A2,则用BC表示的反应速率为_____________。下列关于该反应的说法中正确的是________。
A.增加BC2的浓度始终不能提高正反应速率
B.若混合气体的密度不再发生变化,则反应达到最大限度
C.A2是一种高效优质新能源
D.若生成1 mol A2,转移2 mol 电子
(3)用A元素的单质与C元素的单质及由A、C、D三种元素组成的化合物的溶液构成燃料电池,写出该电池的电极反应式:负极____________,正极__________________。
有关元素X、Y、Z、D、E的信息如下
| 元素 |
有关信息 |
| X |
元素主要化合价为—2,原子半径为0.074nm |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色。 |
| D |
最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: ,D2Z水溶液显 性用离子方程式表示其原因 。
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感。YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得。请写出反应的离子方程式: 。
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

该苛性钾溶液中KOH的质量是 g,该反应中转移电子的物质的量是 mol。
下表是元素周期表的一部分,针对表中元素,填写下列空白
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
| 三 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
(1)比HCl、H2S更稳定的氢化物是:__________________
(2)P、N、Mg原子半径由小到大的顺序是:_____________________
(3)Cl—的离子结构示意图是:________________________
(4)最高价氧化物对应水化物酸性最强的是:____________ (填名称)。:
(5)形成化合物种类最多的元素是:____________
(6)Si的最高价氧化物对应的水化物的化学式为:__________________
(7)Na与CuSO4溶液反应的化学方程式为(分步写): ;
。