类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是
| A.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
| B.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
| C.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3 |
| D.NaHSO4与NaHSO3溶于水显酸性,由所有酸式盐溶于水显酸性 |
下列叙述错误的是:
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H= -114.6kJ·mol-1 则中和热为57.3kJ·mol-1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
| A.②④⑥ | B.①⑤⑥ | C.②③④ | D.①⑤⑦ |
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成化合物CE。下列说法正确的是
A.五种元素中原子半径最大的是E,最小的是A
B.A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物
C.E最高价氧化物对应水化物化学式为H2EO4
D.C的单质在空气中燃烧产物的化学式为C2O
通过分析元素周期表的结构和各元素性质的变化趋势,下列关于砹(原子序数为85)及其化合物的叙述中肯定不正确的是
| A.由KAt的水溶液制备砹的化学方程式为2KAt+Cl2===2KCl+At2 |
| B.相同条件下HAt比HI稳定 |
| C.AgAt是一种难溶于水的化合物 |
| D.At元素位于第六周期 |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示, 其中T单质和H2在光照的条件下发生爆炸。则下列判断正确的是
| A.五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强 |
| B.氢化物的稳定性:R>Q>X;R>T>X |
| C.Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 |
| D.X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①Be的氧化物的水化物可能具有两性
②第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体 ⑥H2Se是无色、有毒、比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
第三周期元素,最高价氧化物对应水化物(浓度均为0.01mol·L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是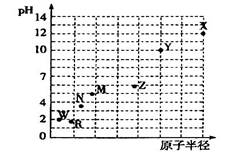
| A.气态氢化物的稳定性:N>R |
| B.Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C.Y的单质是制造汽车、飞机、火箭的重要材料 |
| D.R的单质没有同素异形体 |
X、Y、Z、w是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、w原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< w |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
短周期元素A、B、C、D在周期表中所处的位置如图所示。A、B、C、D四种元素的质子数之和为36。E元素原子的半径在同周期中最大,且E的离子与C的离子具有相同的电子层结构。则下列说法正确的是
A.元素A形成的气态氢化物一定是正四面体形分子
B.五种元素形成的氢化物中,C的氢化物的沸点最高
C.A、C两种元素可形成A3C2型化合物,该化合物在空气中不能燃烧
D.B、C、D、E四种元素的离子半径由大到小的顺序为D>B>C>E
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
| A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱 |
| B.若HnXOm为强酸,则Y是活泼非金属元素 |
| C.若Y的最低化合价为-2,则Z的最高正化合价为+6 |
| D.若X的最高正化合价为+5,则五种元素都是非金属元素 |
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述错误的是
| A.它是副族元素 |
| B.它是第六周期元素 |
| C.它的原子核内有63个质子 |
| D.它的一种同位素的核内有89个中子 |
砷为第四周期第ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是
| A.砷在通常状况下为固体 |
| B.砷的最高正化合价为+5 |
| C.砷的最高价氧化物的水化物砷(H3AsO4)的酸性比磷酸(H3PO4)强 |
| D.砷化氢(AsH3)不如氨气(NH3)稳定 |
构成A、B、C、D、E五种物质的元素中,只有一种不属于短周期元素。A、B、C、D、E五种物质之间的转化关系如图所示:
下列判断错误的是
A.若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式为(NH4)2SO4
B.若A和B都是盐,A难溶于水,而B易溶于水,D不溶于稀硝酸,C为无色无味气体,则B的化学式为NaHSO4
C.若A是2∶1 型的离子化合物,B是硫酸盐,D既可溶于稀盐酸又可溶于NaOH溶液,且A与B的物质的量之比为3∶1时恰好完全反应,则B的化学式为Al2(SO4)3
D.若A是1∶1型的离子化合物,A与过量的B溶液反应才有D生成;将C燃烧的产物通过装有碱石灰的干燥管或盛有浓硫酸的洗气瓶,两者的质量都增加,则B的化学式一定为Al2(SO4)3
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:① R、Y原子的最外层电子数与电子层数相同;② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;③ W与R同主族。下列说法正确的是
| A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 |
| B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W |
| C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键 |
| D.由Y和T组成的物质YT,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |