山东省德州市高三第二次模拟理综化学试卷
化学在人类生活中扮演着重要角色,下列叙述正确的是
| A.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
| B.利用化学反应可实现12C到14C的转化 |
| C.“血液透析”利用了胶体的性质 |
| D.气象环境报告中新增的“PM2.5”是对一种新分子的描述 |
下列有关化学概念或原理的论述中正确的是
| A.由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
| B.电解精炼铜,电解结束后电解质溶液浓度不变 |
| C.海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
某一不饱和酯类化合物(如图)在药物、涂料等领域应用广泛,下列有关说法不正确的是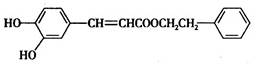
| A.能使KMnO4溶液褪色 |
| B.1mol的该化合物和足量的钠反应生成1molH2 |
| C.能与溴发生取代反应和加成反应 |
| D.1mol该化合物最多与2molNaOH反应 |
第三周期元素,最高价氧化物对应水化物(浓度均为0.01mol·L-1)的pH值与原子半径的关系如图所示,则下列说法正确的是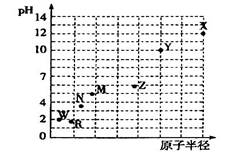
| A.气态氢化物的稳定性:N>R |
| B.Z的最高价氧化物对应的水化物能溶于稀氨水 |
| C.Y的单质是制造汽车、飞机、火箭的重要材料 |
| D.R的单质没有同素异形体 |
下列图示与对应的叙述不相符的是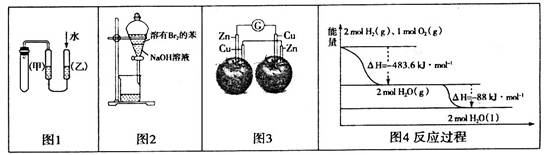
| A.图1的目的是检验装置的气密性 |
| B.图2中分液漏斗振荡静置后,上层液体颜色变浅 |
| C.图3中电流计的指针不发生偏转 |
| D.图4液态水分解的热化学方程式为:2H2O(1)=2H2(g)+O2(g) △H=+571.6KJ/mol |
下列叙述正确的是
| A.含4NA个离子的固体Na2O溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol·L—1 |
| B.Na2S在空气中长期放置变浑浊的离子方程式为:2S2一+O2+2H2O=2S↓+4OH— |
| C.可以用澄清石灰水鉴别Na2CO3和NaHCO3 |
| D.滴加KSCN显红色的溶液中存在:NH4+、K+、C1一、I一 |
下列说法正确的是
| A.pH=5的H2S溶液中,c(H+)=c(HS一)=1×10—5mol·L-1 |
B.含有AgCl和AgI固体的悬浊液中, |
| C.在新制氯水中加入氯化钠固体,水的电离平衡不移动 |
| D.若R为Zn,则上图采用了牺牲阳极的阴极保护法 |
(18分)化学反应原理在生产和科研中有着重要的应用,请利用相关知识回答下列问题。
(1)一定条件下在密闭容器中加入NH4I发生反应:
则反应a的平衡常数表达式为_________;达到平衡后,扩大容器体积,反应b的移动方向_______(填正向、逆向或不移动)
(2)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4∆H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
| A.b点的操作是压缩注射器 |
B.c点与a点相比, 增大, 增大,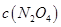 减小 减小 |
| C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc |
D.d点: (正)> (正)>  (逆) (逆) |
(3)利用反应 构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。
①电极a为__________极,其电极反应式为_________________。
②当有2.24LNO2(标准状况下)被处理时,转移电子为____________mol。
③为使电池持续放电,该离子交换膜需选用____________交换膜。
(4)使用硼氢化钠(NaBH4)为诱导剂,可使Co2+与肼(N2H4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式_______________________。
②在纳米钴的催化作用下,肼(N2H4)可分解生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,为抑制肼的分解,可采取的合理措施有____________(任写一种)。
(16分)一种新型高效净水剂PAFC——聚合氯化铁铝[A1Fe(OH)nC1(6-n)]m,应用非常的广泛。
(1)为测定PAFC中Al的含量,采用如图所示流程进行。
回答下列问题:
①步骤I中的试剂A是______________(填“氨水”或“氢氧化钠溶液”)。
②步骤III的离子方程式为__________________________________________。
③实验室进行“灼烧”时所需的陶瓷仪器有__________________________。
④溶液2中存在的电荷守恒式为_________________________________;向溶液2中滴加少量NaOH镕液,则 ______________(填“变大”、“变小”或“不变”)。
______________(填“变大”、“变小”或“不变”)。
(2)C和某一金属在高温下发生反应可用于焊接钢轨,其化学反应方程为______________;某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无Fe2O3,他的判断是否正确?________(填“是”或“否”);其理由是____________(用离子方程式解释)。
(19分)实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如图所示:回答下列问题:
(1)仪器a的名称为__________;B中H2O2发生___________反应(填“氧化”、“还原”或“非氧化还原”);装置C的作用是___________。
(2)该实验必须使NaClO3稍微过量,目的是_________________。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意_______________________。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为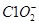 ,则另一种为____________。
,则另一种为____________。
(5)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入__________(填序号,下同)酸化,再加入____________检验。
①稀HNO3 ②稀H2SO4 ③K2SO3溶液
④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(6)25℃时,浓度均为0.1 mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中 _____________
_____________ (填“>”“<”或“=”;已知HC1O2的电离常数为1.1×10-2mol·L-1,CH3COOH的电离常数为1.7×10-5mol·L-1)若要使两溶液的pH相等应___________(填序号)
(填“>”“<”或“=”;已知HC1O2的电离常数为1.1×10-2mol·L-1,CH3COOH的电离常数为1.7×10-5mol·L-1)若要使两溶液的pH相等应___________(填序号)
a.向NaClO2溶液中加适量水
b.向NaClO2溶液中加适量NaOH固体
c.向CH3COONa溶液中加CH3COONa固体
d.向CH3COONa溶液中加适量的水
选做【化学——物质结构与性质】(12分)
(1)X难溶于水、易溶于有机溶剂,其晶体类型为___________;Cu2+的核外电子排布式为__________。
(2)M中所含元素的电负性由大到小顺序为_______,N原子以___________轨道与O原子形成 键。
键。
(3)上述反应中断裂和生成的化学键有___________(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)铜晶胞的结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为________。
选做【化学——有机化学基础】(12分)枯茗醛可用作食用香精。现由枯茗醛合成兔耳草醛,其合成路线如下: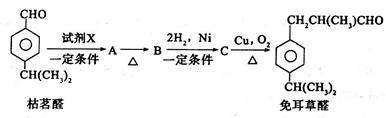
已知醛在一定条件下发生如下反应: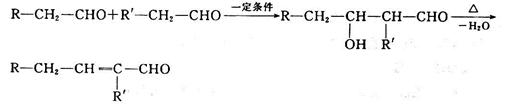
请回答下列问题:
(1)写出试剂X的结构简式:____________。
(2)写出有机物B中所含官能团的名称为_____________;A→B的反应类型为__________。
(3)检验B中的官能团所需的试剂是_________(填序号)。
| A.银氨溶液 稀盐酸 溴水 |
| B.新制氢氧化铜悬浊液稀硫酸酸性高锰酸钾溶液 |
| C.新制氢氧化铜悬浊液 稀盐酸 溴水 |
| D.银氨溶液稀硫酸酸性高锰酸钾溶液 |
(4)写出有机物C生成兔耳草醛的化学方程式:_________________________。
(5)芳香族化合物Y与枯茗醛互为同分异构体,Y具有如下特征:
a.不能发生银镜反应,可发生消去反应;
b.核磁共振氢谱显示:Y消去反应产物的苯环上只存在一种化学环境的氢原子;
写出Y可能的结构简式:_____________、______________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号