已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1 ℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍, B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为_______________________________。
(2)AB2分子中,A的杂化类型为_______________________________。
(3)AB2形成的晶体的熔点________(填“大于”、“小于”或“无法判断”)CD形成的晶体的熔点,原因是_________________________。
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为_______(用元素符号表示)。
(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:
若a=5.6×10-8 cm,则该晶体的密度为________g·cm-3(精确到小数点后1位)。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的电负性比Y的 (填“大”或“小”);X 和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式,并标出电子转移的方向和数目:
(4)在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称: 。氢元素,X、Y的原子也可共同形成多种分子和几种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式: 。
A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大; B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),D形成的分子为单原子分子.回答问题:
(1)Y的电子式为___________;
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为___________;
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式___________;
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式___________,这两种盐均含有的化学键类型为___________;
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量.写出该反应的热化学方程式为___________;
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题: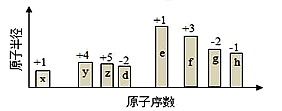
(1)f 在元素周期表的位置是__________。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:_______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为__________;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________。(填序号)
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: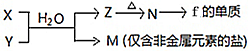
①
 X溶液与Y溶液反应的离子方程式为__________________________
X溶液与Y溶液反应的离子方程式为__________________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1 R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示: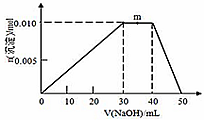
①写出m点反应的离子方程式____________。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式为           。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式               。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是                           。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是                             。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为                                                       。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式              ;若0.1 mol该化合物完全反应,转移电子的物质的量为             。
下图是元素周期表的框架,请在表中①~⑩元素中回答问题
请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为__________________________。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为_______________________。
(3)⑧与⑩两种元素非金属较强的是________,请用一个离子方程式证明该结论_________。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式_____________________,电池工作时阴离子定向移动到________极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为____________kJ。
| 化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |
A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
| B |
|
|
| |
|
F |
(1)BF2的结构式为____________。
(2)D和F的氢化物中沸点较高的是_________(填化学式)。
(3)实验室制取G2气体的离子方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为___________________________________________________。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为_______________________.
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________。
【化学---选修3:物质结构与性质】
已知A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素。E是第四周期元素且最外层只有2对成对电子,F元素与Cr元素位于同一周期的副族元素中且基态原子的最外层电子数与Cr原子相同。

(1)基态E原子的价电子排布图___________________。
(2)B、C、D三元素第一电离能由大到小的顺序为 (用元素符号表示)
(3)BD32-中心原子杂化轨道的类型为__________杂化;CA4+的空间构型为_________________。
(4)1mol BC-中含有π键的数目为______________。
(5)比较D、E元素最简单氢化物的沸点高低: (用化学式表示)。
(6)C、F两元素形成的某化合物的晶胞结构如右图所示,顶点为C原子。则该化合物的化学式是 ,C原子的配位数是 。若相邻C原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为________________g/cm3(用含a、NA的代数式表示)。
X、Y、Z、W是元素周期表前四周期中的四种常见元素,相关信息见下:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第__________周期第__________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_____________(写水化物的化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在_____________个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是_____________,键长较长的是__________;
(3)W的基态原子核外电子排布式是__________W2Y在空气中煅烧生成W2O化学方程式是__________。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为 ,E的基态原子的电子排布式为 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是 ,离子的中心原子采用 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为 。
(4) D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为 。
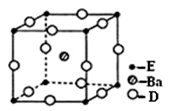
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为 。
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:

①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F周周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置_______________________;
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____________;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有_________;检验该化合物中的阳离子的方法是____________________(用离子方程式表示及文字描述表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:_______________________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________________。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
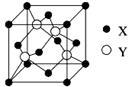
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。