(1)1807年,英国化学家戴维在研究中发现:电解条件下可把水分解成H2和O2。他设想用电解的方法从KOH、NaOH中分离出K和Na。最初,戴维用饱和KOH溶液进行电解,不料还是得到H2和O2。这时,他考虑在无水条件下继续这项实验,但是,实验中产生的金属液珠一接触空气就立即燃烧起来;这时,他又考虑在________条件下电解熔融的KOH继续实验,最后他终于成功地得到了银白色的金属钾。
(2)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第________周期________族。
Ⅱ.关于铷的下列说法中正确的是________(填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳 ③Rb2O2与水能剧烈反应并释放出O2 ④它是极强的还原剂 ⑤RbOH的碱性比同浓度的NaOH弱
Ⅲ.现有铷和另一种碱金属形成的合金5 g,与足量水反应时生成标准状况下的气体2.24 L,则另一碱金属可能是________(填元素符号)。
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物能电离出电子数相等的阴、阳离子。A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层电子数的3倍,B、C的最外层电子数之和与D的最外层电子数相等。E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。请回答下列问题:
(1)C的最高价氧化物对应水化物的化学式为 ,
其中含有的化学键类型为 。
(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为 ________________________________ 。
(3)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是 (填序号)。
①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
A、B、C、D、E、F、G七种短周期元素的原子序数依次增大,其中仅有一种稀有气体元素。A和E最外层电子数相同,短周期主族元素的原子中,E原子的半径最大; B、C和F在周期表中相邻,B、C同周期,C、F同主族,F原子的质子数是C原子质子数的2倍;A和C可形成两种常见的液态化合物X和Y(相对分子质量X<Y ),D形成的分子为单原子分子.回答问题:
(1)Y的电子式为___________;
(2)液态化合物Y与稀H2SO4酸化的K2Cr2O7溶液作用可产生一种无色助燃性气体及可溶性的Cr2(SO4)3,则该反应的离子方程式为___________;
(3)用某种金属易拉罐与A、C、E组成的化合物的水溶液反应,产生的气体可充填气球,请写出该反应的离子方程式___________;
(4)P和Q两种物质都是由A、C、E、F四种元素组成的盐,其水溶液都显酸性,等物质的量的P和Q恰好完全反应.写出该反应的离子方程式___________,这两种盐均含有的化学键类型为___________;
(5)由A、B两元素形成的化合物W可作为火箭推进器中的强还原剂,已知一个W分子和一个Y分子中都含有18个电子,0.5mol液态W和足量液态Y反应,生成一种无色无味无毒的气体B2和液态X,并放出408.8KJ热量.写出该反应的热化学方程式为___________;
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
下表是元素周期表的一部分。表中所列的字母分别代表某一元素。
(1)3A是高效核能原料,其原子核内中子数为____________。
(2)下列有关事实不能用元素周期律解释的是__________。
| A.酸性:H2SO4>H3PO4 | B.碱性:NaOH>Mg(OH)2 |
| C.热稳定性:Na2CO3>NaHCO3 | D.碳在高温条件下将二氧化硅还原为硅 |
(3)B组成的一种微粒与D原子具有相同的核外电子数,写出该微粒的电子式__________。比较E、F两种简单离子的半径大小:E-______(填大于或小于)F+
(4)C和E形成的二元化合物中各原子都满足最外层8电子稳定结构,该物质化学式为_______。该物质极易和水发生反应生成一种具有杀菌消毒作用的产物,试写出该反应的化学方程式___________。
(10分)A、B、C、D均为中学化学常见的纯净物,且存在如图所示转化关系,其中A是单质。
(1)若A是淡黄色固体,B是气态氢化物,C、D是氧化物,C是造成酸雨的主要物质之一。写出B与C发生反应的化学方程式_________________________。
(2)若A、B、D均为两性物质,且A、B生成C的反应均需要强碱溶液。则B生成C的离子反应方程式为________________,在A生成C的反应中每消耗1mol还原剂,可生成气体_______________L(标准状况)。
(3)若组成A、B、C、D的元素为4种短周期元素a、b、c、d,其原子序数逐渐增大,且只有c为金属元素,a、d位于同一主族,b元素原子的最外层电子数是其电子层数的3倍,C、D均为正盐,C是普通玻璃的主要成分之一。则元素d在元素周期表中的位置是________,元素a的最高价氧化物对应水化物的水溶液中离子浓度由大到小的顺序为___________。
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
X、Y、Z三种短周期元素,其中X元素的原子序数大于Y,且X、Y的氧化物都是形成酸雨的主要物质。Z是地壳中含量最高的金属元素;而地壳中含量最高的非金属元素与X同主族、与Y同周期。
(1)实验室用H2XO4制取XO2气体的化学反应方程式为 。(请用具体元素符号表示化学式,下同)
(2)t℃时,0.1 mol·L-1的NaHXO3溶液pH=6,该溶液中各离子浓度由大到小顺序排列为 。
(3)请写出Z的氧化物与烧碱溶液反应的离子方程式 。
(4)一定条件下,YO与YO2存在下列反应:YO(g)+ YO2(g)  Y2O3(g),其平衡常数表达式为K= 。
Y2O3(g),其平衡常数表达式为K= 。
(5)工业上用氧化YH3法制取YO,该反应的热化学方程式为:
4YH3(g)+5O2(g)=4YO(g)+6H2O(g) △H="-905.8" kJ·mol-1;
已知Y2(g)+O2(g)=2YO(g) △H="+180" kJ·mol-1,则YH3与氧气反应产生两种无污染物质的热化学式为 。
(6)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
| 元素代号 |
X |
Y |
Z |
M |
Q |
R |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.037 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
(1)Z在周期表中的位置是_________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是___________(填离子符号)。
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是___________。
(4)Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂.
①甲中所含共价键类型是___________。
②空气阴极法电解制备甲的装置如图所示.在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是_____极,阴极的电极反应式是___________。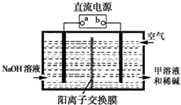
已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
原子的L层上s电子数等于p电子数. |
| X |
元素的原子半径是第三周期主族元素中最大的. |
| Y |
空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z |
单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)z在元素周期表的位置是 。
(2)比较d、f简单离子的半径大小(用化学符号表示,下同) > ;
比较d、g元素的简单气态氢化物的稳定性大小 > 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 。
(5)由上述元素组成的离子化合物 Q:eh 和 W:e2gd4,若电解含2 molQ和2 molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为 mol。
(6)上述元素可组成盐R:zx4f(gd4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中,离子浓度由大到小的顺序是 。
②写出m点发生反应的离子方程式 。
③若在R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式)。
(2)Q的元素符号是 ,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键 。
X、Y、Z、Q、T五种元素位于前四周期,且原子序数依次增大。X、Y的单质在常温常压下呈气态,X 形成的单质分子中无孤电子对,Y的基态原子中p能级上有两个未成对电子,Z原子的半径在同周期主族元素中最大, Q的氧化物是形成酸雨的一种主要物质,T2+所含有的电子数等于Z和Q原子的电子数之和。
(1)Q元素位于元素周期表第 周期 族,T2+的电子排布式为 。
(2)Y元素和Q元素分别形成的组成相似的氢化物中,沸点较高的是 (写化学式),原因是
用惰性电极电解X、Y、Z三种元素形成的化合物水溶液,其阳极的电极反应式为 。
(3)Z与Q形成的化合物的水溶液呈 填“酸性”、“中性”或“碱性”),原因
是 (用离子方程式表示)。
(4)已知在25℃、101325Pa时:
2T(s)+Q(s)=T2Q(s) △H=-79.5KJ/mol
Q(s)+Y2(g)=QY2(g) △H=-296.6KJ/mol
根据上述反应,请写出T2Q与Y2反应生成T与 QY2的热化学方程式 。
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻,C与E同主族,A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)E的名称为______;D的最高价氧化物的水化物的电子式:_________。FAB分子的结构式为_____
(2)A、B、C的氢化物稳定性顺序为(用分子式表示,由大到小)___________________;B的氢化物和B的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为____________________。
(3)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为____________。
(4)一定量的D2C2与AC2反应后的固体物质,恰好与含0.8mol HCl的稀盐酸完全反应,并收集0.25 mol 气体,则固体物质的组成为(写清成分和物质的量)______________________。
(5)在容积不变的密闭容器中进行如下反应:3F2(g)+B2(g) 2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。
2BF3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是______________________(填序号)。
A.平衡不发生移动 B.反应物的转化率减小
C.BF3的质量分数增加 D.正逆反应速率都增大
X、Y、Z、W是元素周期表前四周期中的四种常见元素,相关信息见下:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)Z位于元素周期表第__________周期第__________族,Y和Z的最高价氧化物对应的水化物的酸性较强的是_____________(写水化物的化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在_____________个σ键.在H-Y、H-Z两种共价键中,键的极性较强的是_____________,键长较长的是__________;
(3)W的基态原子核外电子排布式是__________W2Y在空气中煅烧生成W2O化学方程式是__________。