X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:
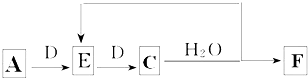
①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为


 下列有关该物质的叙述中,正确的是________。
下列有关该物质的叙述中,正确的是________。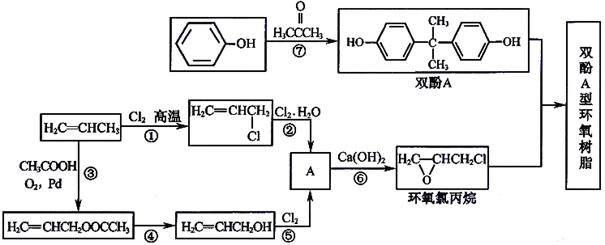
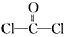 )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________。
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________。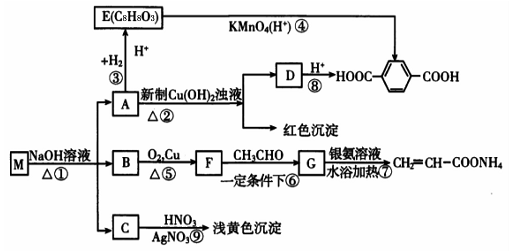



 粤公网安备 44130202000953号
粤公网安备 44130202000953号