A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍, B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为_______________________________。
(2)AB2分子中,A的杂化类型为_______________________________。
(3)AB2形成的晶体的熔点________(填“大于”、“小于”或“无法判断”)CD形成的晶体的熔点,原因是_________________________。
(4)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为_______(用元素符号表示)。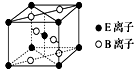
(5)由C、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:
若a=5.6×10-8 cm,则该晶体的密度为________g·cm-3(精确到小数点后1位)。
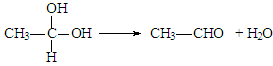
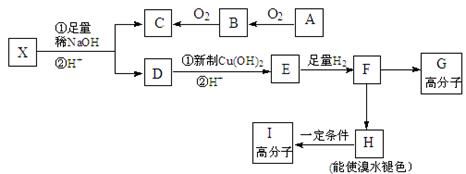
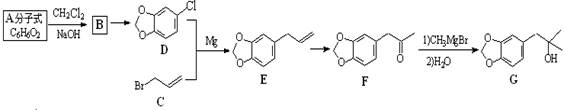
 R-CH2CH2OH
R-CH2CH2OH

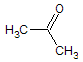 为原料制备
为原料制备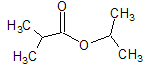 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: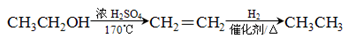

 粤公网安备 44130202000953号
粤公网安备 44130202000953号