现有A、B、C、D四种短周期元素(零族除外),请根据信息回答下列问题。
| 元素 |
A |
B |
C |
D |
| 性质或结构信息 |
元素非金属性较强,其最高价氧化物对应的水化物为强酸,但其单质稳定,常作保护气。 |
原子核外电子占了4个轨道 |
原子半径仅比氢原子大,其氢化物溶于水形成弱酸 |
原子核外有5种不同能量的电子,且s电子数比p电子数少1个 |
(1)A元素原子的核外电子排布式为: 。
(2)写出C元素的单质与水反应的化学方程式 ;A、C两元素的氢化物的稳定性强弱是 > (用化学式表示)。
(3)D元素最高价氧化物对应的水化物呈 (选填“酸性”、“碱性”或“两性”)。
(4)B元素最简单的氢化物分子为 分子(选填“极性”或“非极性”)。4g该氢化物在空气中完全燃烧生成液态水时,放出222.575kJ热量,写出表示该氢化物燃烧热的热化学方程式 。
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。请用元素符号或化学式填空:
(1)所示元素中
①非金属性最强的元素是:
②金属性最强的元素是:
③原子半径最小的是:
④最高价含氧酸酸性最强的是
⑤经常用作半导体材料的元素是: (只写一种)
⑥阴影部分属于元素周期表中的 族,该族元素的最高正价均为
(2)根据元素周期律,推导:
①酸性强弱: H3AsO4 H3PO4(用“>”或“<”表示,下同);
②稳定性:H2S HCl
③沸点:HF HCl
④还原性:I- Br-
⑤在O、F、S、Cl四种元素中,非金属性最接近的是:
A.O和F B.F和S C.S和Cl D.O和Cl
(3)根据同主族元素性质的相似性和递变性进行预测:
①关于Se的预测正确的是:
A. 常温下Se单质是气体
B. Se最高价氧化物的水化物能和NaOH发生反应
C. 氢化物的化学式为H2Se
D. 常见的氧化物只有SeO3
②已知Cl2在水溶液中能和SO2反应,Cl2+2H2O+SO2==H2SO4+2HCl,写出Br2在水溶液中和SO2反应的离子反应方程式___________________________________
元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。

(1)表中T的元素符号为 ,金属性最强的元素是 (填元素符号)。 (2)元素的非金属性:M R(填“>”或“<”)。
(2)元素的非金属性:M R(填“>”或“<”)。 (3)R的最高价氧化物对应水化物的化学式是 。
(3)R的最高价氧化物对应水化物的化学式是 。 (4)F、G两元素形成的淡黄色固体物质的电子式为 ,该物质含有的化学键的类型是 。
(4)F、G两元素形成的淡黄色固体物质的电子式为 ,该物质含有的化学键的类型是 。 (5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是 (填离子符号)。
(5)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是 (填离子符号)。 (6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
(6)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。 (7)A与D形成分子的空间结构可能是(填序号) 。
(7)A与D形成分子的空间结构可能是(填序号) 。
(8分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)E元素在元素周期表中位于第 周期,第 族。
(2)B与D形成化合物BD2的电子式为 。
(3)A、C、D三种元素能形成三类常见化合物,化学式分别为 , , 。
(4)均由A、D、E、F四种元素组成的两种盐溶液相互混合,产生无色有刺激性气味气体,该反应的离子方程式为______。
填写下表:
| 粒子符号 |
质子数Z |
中子数N |
核外电子数 |
质量数A |
| Cl |
17 |
20 |
|
|
| S2- |
|
|
18 |
32 |
| Al3+ |
|
14 |
|
27 |
| AYm- |
|
y |
|
A |
| AXn+ |
x |
|
|
A |
短周期元素A、B、C、D、E原子序数依次增大(稀有气体除外),含C元素的物质焰色反应为黄色,A、C位于同一主族,B的最外层电子数是次外层的3倍,D的最外层电子数是B最外层电子数的一半,B、C的最外层电子数之和与E的最外层电子数相等。请回答下列问题:
(1)写出下列元素符号A B C D
E在元素周期表中的位置是第 周期 主族。
(2)D单质与A、B、C三种元素组成的化合物的水溶液反应,其反应的离子方程式 为 。
(3)0.25 mol A单质与足量的E单质反应,求生成气体的体积(标准状况)(写出计算过程)
今有A、B、C、D、E、F五种元素,A原子核中只含一个质子;B最外层电子数是次外层电子数的2倍;C元素的正三价离子的3d能级为半充满; E原子的M层和N层分别比D原子的M层和N层多5个电子;F原子的N层只有一个电子,而M层为全充满。
(1)写出B的基态原子的价电子轨道表示式
(2)C的元素符号 ,其基态原子的电子排布式为
(3)若E与C能反应生成离子化合物CE3,则D的原子结构示意图为 ;A和B按原子个数比为1:1组成的相对分子质量为78的芳香烃与E的单质反应的化学方程式为
(4)向元素F的硫酸盐中逐滴加入氨水至过量,写出该过程涉及反应的离子方程式:
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E
的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2
反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A_______,B_______, E_______。
(2)画出E的原子结构示意图_____ __。
写出电子式D2A2___ ____,EB4__ _ ____。
(3)比较EA2与EB4的熔点高低(填化学式)_______>_______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点 (填“高”或“低”),原因是 。
短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A离子的离子结构示意图为 ;
(2)C元素在周期表中的位置是 ;
(3)A~D四种元素最高价氧化物对应水化物中,酸性最强的是 ;
(4)向B、C两种元素形成的化合物的水溶液里滴入过量氢氧化钠溶液,写出有关离子方程式__________________________________。
(1)通常情 况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
①用化学符号表示下列4种微粒:
A: ;B: ;C: ;D: 。
②B微粒与D微粒结合质子(H+)的能力大小B D(填大于、等于、小于)
(2)A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分了;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:
①用化学符号表示上述5种微粒:
A 、B 、C 、D 、E .
②在水溶液中A跟B反应的离子方程式是 。
碳是形成化合物种类最多的元素,氮元素可以形成多种化合物,氧是地壳中含量最多的元素。
回答以下问题:(12分,每空2分)
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量.
(2)基态氮原子的价电子排布式是_________ ________。
(3)氧元素基态原子核外未成对电子数为 个。
(4)C、N、O三种元素第一电离能从大到小的顺序是____________。
(5)若某元素E的原子最外层电子排布为2s22 p1,某元素F的原子外围电子排布为2s22p2,则元素E与元素F的电负性从大到小顺序是_____ _______(用元素符号表示)。
元素F在元素周期表 区域(填s、p、d、ds、f区)
氧原子的质量数为16,质子数为8,那么它的中子数是____________。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: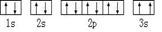
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
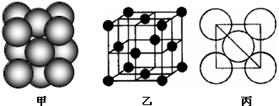
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .