T、X、Y、Z、R、W为周期表前四周期元素,原子序数依次递增。已知:
①W原子最外层有1个电子,属于ds区元素,其余的均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是 __________ ___(用元素符号表示)。
(2)Y的氢化物分子间能形成氢键,R的氢化物分子间不易形成氢键,原因是 。
(3)W的基态原子的价层电子排布式为 ,该元素与元素Y 、T能形成的[W(YT3)4]2+离子中,含有的化学键是 。
a.离子键 b.极性键 c.非极性键 d.配位键
画出其结构式_____________
(4) T、X、Z三种元素组成的一种化合物M是新装修居室中常见的有害气体,它的分子式为XT2Z,分子空间构型为平面三角形,则该分子中中心原子采取_____ 杂化,1molM分子中σ键和π键的个数比为 。
(5) T和Z可以形成个数比为1:1的分子,其中中心原子采取 杂化;通常情况下,该分子与水任意比互溶的主要原因是 。
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)甲元素的名称为 ,溴元素在周期表的位置 丁元素的阴离子结构示意图为 。
(2)A的电子式为 ;所含化学键类型为 。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示) 。
(4)反应(I)的化学方程式为 。
(5)反应(II)的离子方程式为 。
(12分)短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图______________________________。
(2)写出化合物YZ2电子式:______________空间构形为:_______________,
写出化合物C的电子式:_____________化学键类型有:_____________。
(3)写出化合物C在空气中变质的化学方程式:____________________
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E
的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2
反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A_______,B_______, E_______。
(2)画出E的原子结构示意图_____ __。
写出电子式D2A2___ ____,EB4__ _ ____。
(3)比较EA2与EB4的熔点高低(填化学式)_______>_______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点 (填“高”或“低”),原因是 。
①~⑤五种元素在元素周期表中的位置如下图所示:回答下列问题:
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是 ;
(2)②③④元素原子中,半径最小的是 (填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是 (化学式)。该化合物中,化学键的类型为 (选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元索④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是
(化学式);
(5)元素⑤单质与水反应的离子方程式: 。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1) B元素的名称___ _,B在周期表中的位置第 ______周期,第________族;
(2) A、B形成的化合物的电子式____
(3) C的元素符号______,C的最高价氧化物的化学式____
(4) D的最高价氧化物对应的水化物的化学式____ ________
短周期元素中,某些不同族元素的单质及其化合物有相似的化学性质,如铍和铝都能与氢氧化钠溶液反应;下图是元素周期表的一部分,编号为③的元素最外层与最内层电子数等
(1)编号为⑤的元素的符号为 ,其在周期表中位于 。
(2)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式: 。
(3)己知AlCl3的熔点为190 ℃(2.5×105Pa),沸点为182.7℃,
试推测:
①BeCl2是 化合物(填“离子”或“共价”),
②Be(OH)2的碱性比LiOH 。
(4)根据Mg在空气中的燃烧情况, Li在空气中燃烧生成的产物为 __(用化学式表示)。
(1)元素最高正化合价为+6,其负化合价为____,某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为___________
(2)下列各题中有关物质的比较,请用“>”、“<”、“=”填空
酸性: H3PO4 HNO3 ,H2SO4 HClO4
热稳定性:CH4 NH3 ,HCl HI
(3)1-18号元素中,最外层电子数是次外层电子数二倍的元素是 ,原子结构示意图 ,能与氧形成的氧化物的化学式 、 。
X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
⑴ 写出 X3- 的一种等电子体的化学式 ; X的气态氢化物易液化的原因是: 。
⑵写出T元素基态原子的核外电子排布图 ;
Q元素的原子核外有 种运动状态不同的电子。
⑶元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
⑷甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
⑸Y元素在周期表中位于 区。Y单质晶体的晶胞如右图所示,
该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的
堆积方式为 堆积。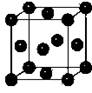
⑹在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
⑺元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
36 g的H2O 和 60 g 的D2O 中, 它们所含有的原子总数之比为 ,分子内的中子总数之比为 ,若它们分别与足量的金属钠反应, 产生的气体的质量之比为 。
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)N、O、S三种元素的第一电离能大小顺序为: > > 。(填元素符号)
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个 顶点,该晶体中 X、Y、Z的粒子个数比为______________;
顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(3)按所示格式填写下表有序号的空格:
| 原子序数 |
原子价层电子排布 |
周期 |
族 |
| 17 |
① |
第三 |
② |
| ③ |
3d54s1 |
④ |
ⅥB |
(4)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素的最高价氧化物对应的水化物的化学式是 。
,则该元素的最高价氧化物对应的水化物的化学式是 。
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: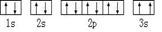
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .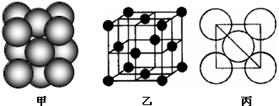
(每空1分,共20分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、_____晶体。
(7)画出D的核外电子排布图_____________________,这样排布遵循了_______规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________