碳是形成化合物种类最多的元素,氮元素可以形成多种化合物,氧是地壳中含量最多的元素。
回答以下问题:(12分,每空2分)
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量.
(2)基态氮原子的价电子排布式是_________ ________。
(3)氧元素基态原子核外未成对电子数为 个。
(4)C、N、O三种元素第一电离能从大到小的顺序是____________。
(5)若某元素E的原子最外层电子排布为2s22 p1,某元素F的原子外围电子排布为2s22p2,则元素E与元素F的电负性从大到小顺序是_____ _______(用元素符号表示)。
元素F在元素周期表 区域(填s、p、d、ds、f区)
(7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
|
|
|
|
(1)①-⑧中金属性最强的元素是(元素符号)___________。
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______、_______。
(3)A、B、C、D、中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为 ,Y的化学式为 ;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
。
短周期元素U、V、W、X、Y原子序数递增,V、W、X、Y四种元素依次相邻,可组成U2X、WU3、VU4型10电子化合物,也可组成U2Y、U2X2、W2U4、V2U6型18电子化合物。请据各情景回答问题。
⑴上述两种相对分子质量相等的18电子化合物在水溶液中相互反应,生成一种固体单质。写出有关化学方程式: 。
⑵WU3在NaClO溶液中生成W2U4,写出有关离子方程式 。
⑶U2X2和W2U4常温下均是无色液体,相互反应生成两种气体产物,均是大气成分。在pkPa、t℃时测得每生成36g U2X放出320kJ热量。写出有关热化学方程式: 。
⑷W2U4—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池放电时:负极的电极反应式是 。
氧原子的质量数为16,质子数为8,那么它的中子数是____________。
(共10分) W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素名称:W_________,X________,Y________,Z_________;Z在元素周期表中的位置_______ __。
(2)Y2Z的电子式为_______ __;W2X2的结构式__________。
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是 _______
(每空1分,共20分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、_____晶体。
(7)画出D的核外电子排布图_____________________,这样排布遵循了_______规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
(12分)短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图______________________________。
(2)写出化合物YZ2电子式:______________空间构形为:_______________,
写出化合物C的电子式:_____________化学键类型有:_____________。
(3)写出化合物C在空气中变质的化学方程式:____________________
A、B、C三种短周期元素在周期表中相对位置如右图:
| A |
|
|
|
| |
|
B |
C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是: > > (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
①写出X与Z反应的离子方程式: 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
每空2分,共10分)
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。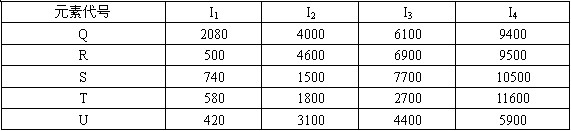
(1)在周期表中,最可能处于同一族的是( )
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物或氧化物,阴极电极反应式最可能正确的是( )
A.Q2++2e-→Q B.R2++2e-→R C.S3++3e-→S
D.T3++3e-→T E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是( )
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1)E 氦(1s2)