在 H,
H, H,
H, H,
H, Mg,
Mg, Mg,
Mg, O,
O, O,
O, O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是 。D218O的相对分子质量是______。
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态E原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_______。
(2)E3+离子的价层电子排布式为______________。
(3)DCl2中D原子采取的轨道杂化方式为_________________________,C元素的气态氢化物的VSEPR模型名称为____________________________。
(4)写出一个与DAB-离子互为等电子体的合理分子式:__________________________。
(5)利用E(AB)63-检验E2+的离子方程式为_________________________。
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为_______________个。(保留3位有效数字)
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):
已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子。
(1)写出单质X的结构式是__________________________________;
(2)化合物甲的电子式是____________________________________;
(3)化合物丙中存在的作用力是______________________________。
碱金属元素原子最外层的电子数都是 个,碱金属元素中金属性最强的是 ,原子半径最小的是 。卤素原子最外层的电子数都是 个,;在卤族元素中非金属性最强的是 。
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
| X |
Y |
|
| |
Z |
W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
(1)原子种类由________决定。(填写字母序号,下同)
(2)元素种类由________决定。
(3)元素有无同位素由________决定。
(4)1~18号元素的化合价主要由________决定。
(5)元素的化学性质由________决定。
已知M、Q、X、Y、Z是前四周期中元素(不包含稀有气体元素),有关性质和相关信息如下表:
| 元素 |
相关信息 |
| M |
最高价氧化物对应的水化物能按1:1电离出电子数相等的阴、阳离子 |
| Q |
所在主族序数与所在周期序数之差为4,非金属性在同周期元素中最强 |
| X |
其单质为淡黄色晶体 |
| Y |
某种核素原子的质量数为56,中子数为30 |
| Z |
X元素的单质在Z元素的单质中燃烧,发出明亮的蓝紫色火焰 |
(1)下图是不完整的元素周期表,补全元素周期表的轮廓,并将Y的元素符号填在元素周期表中相应的位置上。
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)M与Z形成的含有共价键的化合物的电子式为 。
(3)M、Q、Z简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)用一个化学方程式表示证明非金属性Q>X: 。
(5)5.6L标准状况下的X的简单氢化物在足量的Z单质中完全燃烧生成液态水时,放出的热量为356.8kJ。该反应的热化学方程式为 。
(6)在碱性条件下,Q的单质可与YZ2-反应制备一种可用于净水的盐YZ42-,该反应的离子方程式为。
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。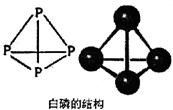
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
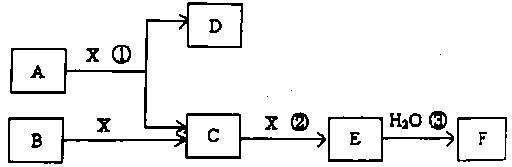
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
(2)XZ 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如图所示,则该化合物的化学式为 。