有A、B、C、D、E、F六种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数比C元素大11。请回答:
(1)元素 X与C、B均相邻,比较C、X元素的第一电离能Il(C) I1(x)
(2)写出F元素原子的核外电子排布式 。
(3)位于C元素上周期同主族元素的氢化物沸点最高的原因是 ,其分子中心原子的杂化方式为 ,空间构型为 。
(4)D的最高氧化物是 分子(填“极性”或“非极性”),l mol这种氧化物分子中含有 molπ键,E的最高价氧化物的晶体类型是 。
下列各组物质中: ③H2O和 D2O
③H2O和 D2O
④ CH3CH3和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是; ; 互为同素异形体是: ;
互为同分异构体是: ; 互为同系物的是___ 。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有2对成对电子 |
| X |
基态原子核外电子共占据5个原子轨道且有2个未成对电子, |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。
(2) 元素Z与元素T相比,非金属性较强的是________(用元素符号表示),
(3)下列表述中能证明“元素Z与元素T相比,非金属性较强的”这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)元素X和元素Y的第一电离能的大小关系为_________,请说明理由_______________。
(5)CO和Y2是等电子体,CO和Y2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子)。下表是两者的键能数据:(单位:kJ/mol)
| |
A-B |
A=B |
A≡B |
| CO |
357.7 |
798.9 |
1071.9 |
| Y2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比Y2活泼的原因:______________________________________。
若b为非金属元素,则以下推断正确的是_________(选填编号)。
①a一定是金属元素 ②d一定是金属元素 ③f一定是非金属元素
A、B、C三种短周期元素在周期表中相对位置如右图:
| A |
|
|
|
| |
|
B |
C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是: > > (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
①写出X与Z反应的离子方程式: 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
电子层数相同的元素随着原子序数的递增,原子半径依次_______,核电荷数依次______,(填增加或减少)核对最外层电子的引力依次______,原子失去电子的能力逐渐______,得电子的能力逐渐_____,所以金属性依次_______,非金属性依次__________。
(填增强或减弱)
黑火药是中国古代四大发明之一,它的爆炸反应为:
(1)生成物中除了氮气与二氧化碳外,还有一种物质A生成,则A的电子式为 ,A属于 晶体。
(2)黑火药中位于元素周期表短周期的元素有 种。其中一种元素的单质可用于制药,其氧化物可用于漂白织物和防腐剂,该元素在周期表中的位置是 ,该元素的原子核外有 种不同运动状态的电子。
(3)黑火药中所含元素的原子半径从大到小的顺序是 (用元素符号表示);
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有 。
| A.同条件同浓度溶液pH:Na2CO3>Na2SO4 | B.酸性:H2SO3>H2CO3 |
| C.CS2中碳元素为+4价,硫元素为-2价 | D.分解温度:CH4>H2S |
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:
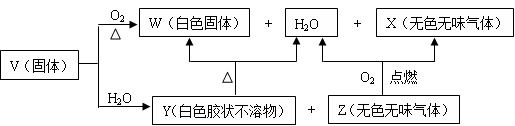
(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
在周期表中氧化性最强的一族元素是 ,它们原子最外层上的电子数目都是 。
该族元素氢化物的通式是 ,最高价氧化物的通式是 。该族元素氢化物的水溶液显 ,最高价氧化物的水化物显 。该族元素随核电荷数的递增,原子半径逐渐 ,氧化性逐渐 。
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。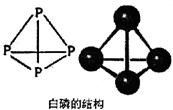
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
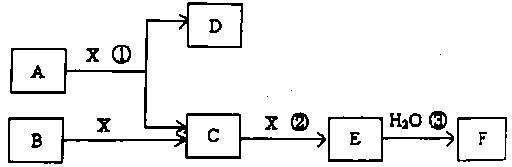
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。
原子序数依次增大的X、Y、Z、M、N五种元素,XZ2是引起温室效应的主要气体,M最外层电子数是电子层数的2倍,,N2+核外3d有9个电子,请回答下列问题:
(1)N位于元素周期表的 区,X、Y、Z的电负性最大的为 。
(2)XZ 中中心原子杂化方式为 。
中中心原子杂化方式为 。
(3) Z的氢化物(H2Z)在乙醇中的溶解度大于H2M,其原因是 。
(4)Na2M2Z3还原性较强,在溶液中易被Cl2氧化成MZ ,常用作脱氯剂,该反应的离子方程式为 。
,常用作脱氯剂,该反应的离子方程式为 。
(5)N与Y可形成的一种具有良好的电学和光学性能的化合物,其晶胞结构如图所示,则该化合物的化学式为 。