利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。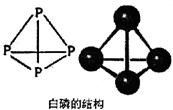
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的电子排布式为 ;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。
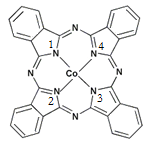
①酞菁钴中三种非金属原子的电负性由大到小的顺序为 ;
(用相应的元素符号作答);碳原子的杂化轨道类型为 ;
②与钴离子通过配位键结合的氮原子的编号是 ;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
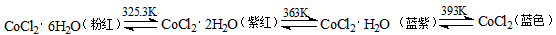
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用: ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过 量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式: ;
(5)Co的一种氧化物的晶胞如右图所示,在该晶体中与一个钴原子等距离且最近的钴原子有________个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述CoO2的化学组成的是 。
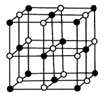
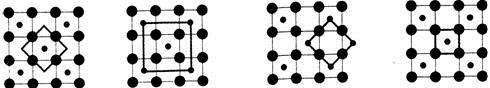
A. B. C. D.
填空题
(1)碳原子最外电子层含有__________个电子,一个碳原子可以跟其他非金属原子形成__________共价键。
(2)在有机合成过程中,引入碳碳双键的三种方法是_____________、________________、_____________。
(3)根据官能团不同,单糖可分为_______________和________________________。
(4)核酸分为DNA和RNA,DNA的主要功能是________________;RNA的主要功能是____________。
神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为 。
②取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法 。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为: 。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式 。
卤族元素的单质能与H2反应
| H2+F2=2HF |
在暗处能剧烈化合并发生爆炸 |
| H2+Cl2=2HCl |
光照或点燃发生反应 |
| H2+Br2=2HBr |
加热至一定温度才能反应 |
| H2+I2=2HI |
不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的__________族。
(2)用电子式表示HCl的形成过程__________。
(3)依据上表,可以推测出:随着原子序数的递增,__________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式____________。
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O。
(1)Cu2+基态核外电子排布式为 ;[Cu(NH3)4]SO4·H2O中,与Cu2+形成配位键的原子是 (填元素符号)。
(2)乙醇分子中O原子轨道杂化类型为 。与NH3互为等电子体的一种阳离子为 (填化学式)。
(3)N、O、S第一电离能由大到小的顺序为 。
(4)某含有结晶水的铜的氯化物的晶胞结构如右图所示,该化合物的化学式是 。

周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3 >Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
| X |
Y |
|
| |
Z |
W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。F原子核外最外层电子数与Na相同,其余各层电子均充满。
(1)E3+的价电子排布式为 。
(2)AB32— 的立体构型是 ,其中A原子的杂化轨道类型是 。
(3)A22— 与B22+ 互为等电子体,B22+的电子式可表示为 ___________,1mol B22+ 中含有的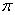 键数目为 。
键数目为 。
(4化合物DC2的晶胞结构如右图所示,形成的离子化合物的电子式为__________该离子化合物晶体的密度为a g/cm3,则晶胞的体积是 ____ cm3(只要求列算式,阿伏加德罗常数的值为NA)。
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
(1)基态Fe3+的M层电子排布式为 ;
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
(4)常温条件下,铁的晶体采用如图所示的堆积方式.则这种堆积模型的配位数为 ,如果铁的原子半径为a cm,阿伏加德常数的值为NA,则此种铁单质的密度表达式为 g/cm3.

V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:
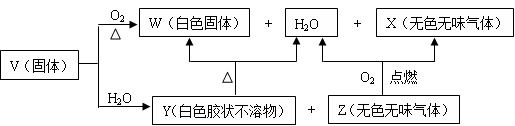
(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
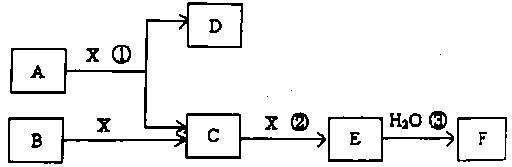
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②A的分子结构模型为 。
③已知常温下46g气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方程式 。
④在常温下,向V1LpH=a的A溶液中加入V2LpH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填 无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物H,H的Ksp=8.1×10—9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其Ksp ,(填:增大、减小或不变),此时,组成不溶物H的阴离子在溶液中的浓度为 mol/L。